左旋多巴宽频太赫兹光谱研究  下载: 1139次
下载: 1139次
1 引言
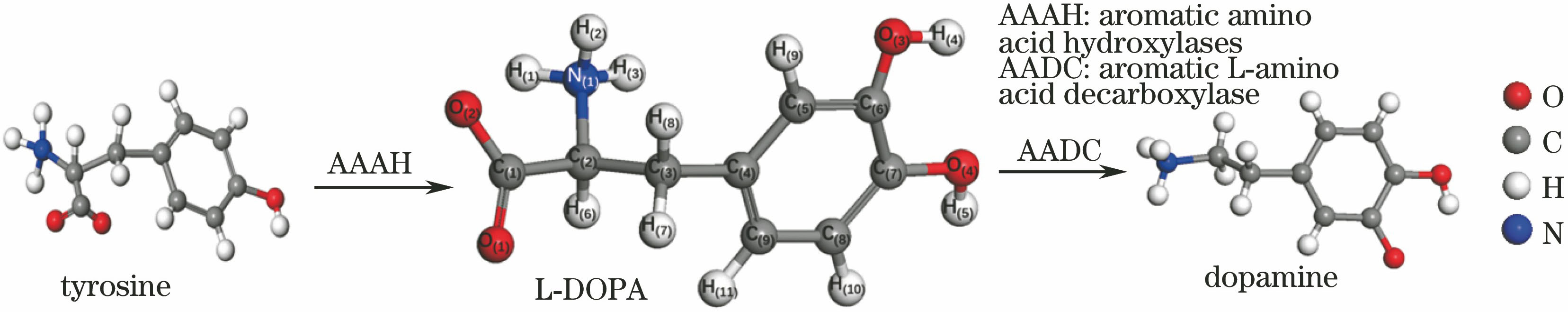
左旋多巴又名β-3,4-二羟苯基-α-丙氨酸(L-DOPA),是体内酪氨酸代谢产物,也是肾上腺素类和多巴胺等重要神经递质的前体衍生物。L-DOPA在人体中枢神经系统内经多巴脱羧酶转化成多巴胺,其生理功能与神经系统的神经传递密切相关,同时L-DOPA也是治疗帕金森病(PD)的关键药物,在临床上具有重要应用[1]。L-DOPA分子由一个刚性的苯环和柔性的支链组成,具有氨基酸的特性,通常以两性离子形式存在。其中苯环上两个相邻的酚羟基以及支链上的氨基和羧基属于功能性官能团,与分子的生物学效应密切相关。这些官能团能够形成丰富的氢键网络,在维持其分子结构和发挥生物学功能方面具有重要作用。生物分子的振动光谱能够揭示分子内和分子间的弱相互作用,有助于揭示与生物活性相关的构型和构象特点[2-4]。最近,Edwin等[5]利用傅里叶变换红外光谱(FTIR)和拉曼光谱分别获得了L-DOPA在400~4000 cm-1和50~3500 cm-1范围内的光谱特征,并利用密度泛函理论(DFT)的力场计算研究了单分子L-DOPA以及二聚体的振动特性,结果表明,分子中的氢键对L-DOPA生物活性起着关键作用,影响其构象和生物学功能。
随着超快激光技术的发展,近年来太赫兹时域光谱技术(THz-TDS)已成为研究生物分子远红外振动特性的一种有效的无损检测方法,如脱氧核糖核酸(DNA)、蛋白质和氨基酸等生物分子的识别和构象分析[6-7]。借助生物分子在太赫兹波段特有的指纹光谱,THz-TDS可以实现无标记生物分子探测[8-9],在生物医学领域具有广阔的应用前景[10-12]。已有多个课题组针对L-DOAP的前体化合物酪氨酸在太赫兹波段的光谱吸收进行了研究,并取得了一定的研究进展[13-15]。Yan等[14]认为0.2~2.0 THz范围内的特征吸收峰来自于分子的集体振动。最近,Peng等[16]研究了0.5~4.5 THz范围内包括盐酸多巴胺等神经活性物质的指纹光谱,并对不同混合物进行了有效的区分,这些结果为神经相关活性分子的鉴别和定量分析提供了帮助。张希成课题组[17-18]提出将空气等离子体作为强太赫兹源和探测介质,实现了高信噪比的太赫兹超宽谱探测。利用空气等离子体作为太赫兹脉冲的探测介质,具有无损伤阈值、无反射回波、无声子吸收以及对热背景不敏感等优势,可以进行超宽频的太赫兹光谱测量,获取更宽域的太赫兹指纹信号,为生物体系的无标记探测提供了更多帮助。
本文采用宽频空气等离子体太赫兹系统对L-DOPA进行探测,获得了0.5~14.5 THz频率范围的指纹谱,并利用基于非线性光学晶体LiNbO3的快速扫描太赫兹系统考察了0.5~4.5 THz频率范围内L-DOPA的温度依赖性。为了更好地理解太赫兹吸收谱与分子结构及振动特性间的关系,采用密度泛函(DFT)理论对L-DOPA在太赫兹波段的光谱吸收和振动模式进行解析。考虑到分子晶体通常会有多晶型现象,而不同晶型在太赫兹波段有不同的特征响应,利用粉末X射线衍射仪(PXRD)对样品晶型进行测量表征。同时,利用FTIR对宽频空气等离子体系统获得的较高太赫兹范围的L-DOPA特征指纹光谱进行对比,结果发现有较好的吻合。
2 材料与方法
2.1 材料
L-DOPA的纯度为99%,购于百灵威科技有限公司。衬底材料为在太赫兹波段具有良好透过性能的环烯烃共聚物(COC)[19],其粒径为50~100 μm,购于上海原子核研究所实验工厂(SINR)。溴化钾(KBr)的纯度为99%,购于国药集团化学试剂有限公司。
2.2 样品的制备
将衬底COC与样品L-DOPA(结构如
2.3 太赫兹时域光谱系统
本研究采用基于空气等离子体系统的宽频太赫兹光谱仪(天津Terahertz Photonics Co.Ltd., TA-800)采集样品在0.5~14.5 THz范围内的太赫兹吸收谱。Spectra-Physics公司的Spitfire Ace掺钛蓝宝石再生放大器作为光源,输出激光的中心波长为800 nm,脉宽为35 fs,重复频率为1 kHz。用分束片将飞秒激光分为两束(抽运光和探测光),抽运光经透镜聚焦并穿过BBO倍频晶体后产生二次谐波脉冲。基频光和二次谐波脉冲聚焦在空气中,沿聚焦区产生等离子体,进而产生宽带太赫兹辐射。在检测方面,将太赫兹光束和探测光共线聚焦在同一点,产生新的二次谐波脉冲。然后采用400 nm带通滤波器对二次谐波光束进行滤波,并用光电倍增管(PMT)进行检测。由于PMT测量的二次谐波信号的强度与太赫兹波的强度成正比,因此可以从PMT中提取出太赫兹信号。探测光焦点处的电极可引入外部偏置电压,用于相干检测[17-18,20]。其中产生太赫兹的激光脉冲能量约为0.9 mJ,检测的脉冲能量约80 μJ,偏置相电压为1.5 kV。
基于非线性光学晶体LiNbO3的TAS7400TS THz-TDS系统(日本Advantest Corporation,波长为1560 nm,脉宽为50 fs,频率分辨率为1.9 GHz)在本研究中的有效检测范围为0.5~4.5 THz。该系统采用相位调制双激光同步控制技术,可以实现快速扫描。因此,温度效应实验在该系统上完成,利用变温腔(Specac Ltd., UK,精度为±0.5 ℃)在83~293 K温度范围内进行光谱探测。
2.4 参数计算
实验中通过TDS系统获得样品和参考信号的时域谱
式中:
根据Duvillaret[21]等提出的方法可知理论计算的传输函数为
其中,
式中:
2.5 PXRD
采用Bruker D8 Advance系统(Cu源,电压为40 kV,电流为40 mA)对样品的晶体结构进行表征,扫描范围2
2.6 FTIR
采用Nicolet Avatar 370光谱仪(分辨率为4 cm-1)采集样品在400~4000 cm-1范围内的红外光谱数据,以KBr作为衬底。
3 量子化学计算
经PXRD实验证实,本研究所用L-DOPA晶体属于单斜晶系,与文献[
22-23]的结果一致。因此,将该晶体在数据库中的晶体单元参数[空间群是
4 结果与讨论
4.1 L-DOPA宽频太赫兹吸收光谱

图 2. 室温下,L-DOPA的宽频太赫兹吸收光谱
Fig. 2. Broadband THz absorption spectra of L-DOPA at room temperature
4.2 L-DOPA的温度效应

图 4. L-DOPA太赫兹吸收光谱的温度依赖
Fig. 4. Temperature dependence of THz absorption spectra of L-DOPA
4.3 L-DOPA太赫兹光谱的理论分析
量子化学理论计算是分析实验所得太赫兹吸收光谱行之有效的方法[32]。考虑到分子间丰富的氢键网络和相互作用,本研究采用晶胞的形式进行结构优化和振动光谱分析,

图 6. L-DOPA在1.90,2.95,3.27,9.46,10.57,11.01 THz处的振动模式
Fig. 6. Vibrational modes of L-DOPA at 1.90, 2.95, 3.27, 9.46, 10.57, and 11.01 THz
表 1. L-DOPA光谱比较以及吸收峰的振动模式
Table 1. Comparison of spectra and vibrational modes of absorption peaks of L-DOPA
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5 结论
本研究利用空气等离子体宽频太赫兹时域光谱系统获得了具有重要生物学意义的L-DOPA在0.5~14.5 THz范围内的吸收光谱,并观察到一系列特征吸收峰,这些太赫兹指纹谱为分子检测和鉴定提供了参考。采用基于非线性光学晶体LiNbO3的TAS7400TS快速扫描系统对L-DOPA温度效应进行研究,结果表明,随着温度降低,太赫兹吸收峰的强度逐渐增大,在所测范围内,除2.05 THz处的峰位发生较小红移外,其他共振吸收峰均表现为
蓝移,且频移程度不同。利用DFT理论计算方法对实验所得光谱进行解析,结果表明,L-DOPA分子的集体振动分布较广,且苯环和分子侧链表现出不同的振动特点,同时观察到了分子的局域振动,这些振动特异性与分子构象及分子间的氢键等弱相互作用密切相关,分子结构和环境的微小变化会进一步影响神经活性分子与受体的相互识别以及结合状态。
[6] Takahashi M. Terahertz vibrations and hydrogen-bonded networks in crystals[J]. Crystals, 2014, 4(2): 74-103.
[9] Ho L, Pepper M, Taday P. Signatures and fingerprints[J]. Nature Photonics, 2008, 2(9): 541-543.
[10] 刘国治. 关于生物神经系统物理机理的若干猜想[J]. 科学通报, 2018, 63(36): 3864-3865.
Article Outline
朱中杰, 任冠华, 成超, 吴志鹏, 张建兵, 韩家广, 赵红卫. 左旋多巴宽频太赫兹光谱研究[J]. 中国激光, 2019, 46(6): 0614017. Zhongjie Zhu, Guanhua Ren, Chao Cheng, Zhipeng Wu, Jianbing Zhang, Jiaguang Han, Hongwei Zhao. Broadband Terahertz Spectroscopy of Levodopa[J]. Chinese Journal of Lasers, 2019, 46(6): 0614017.