豆类种子自然老化过程的红外光谱研究  下载: 1170次
下载: 1170次
1 引言
种子老化是指种子活力的自然衰退,即种子生活力逐渐减弱以至完全丧失的过程。随着储藏时间的延长,种子会发生复杂的生理生化变化,如自身的呼吸氧化、各种酶活动。受到外界干扰后,种子的发芽率会降低,活力减弱,蛋白质、DNA和RNA的合成能力下降[1-2]。此外,种子内有毒有害物质的累积会使其发霉腐烂,这会严重影响粮食生产及食品安全[3]。因此,种子老化的鉴定对农业生产具有重要意义。利用发芽率、发芽势和电导率测定种子活力[4]的方法耗时费力;以色泽、式样等鉴定种子品质的方法会受鉴定人员主观意识的影响。此外,有研究者利用电泳法和TCA丙酮法[5]、免疫测试和抗氧化反应法[6]、聚合酶链式反应法[7]、液相色谱-串联质谱和多种反应监测法[8]、比色法[9]、谷胱甘肽氧化还原电位和差示扫描量热分析法及电子自旋共振法[10]、微卫星[11]法等鉴定种子的老化,但这些方法需要对样品进行预处理,成本高且耗时。
红外光谱三级鉴别法是在傅里叶变换红外光谱(FT-IR)的基础上,通过二阶导数红外光谱(SD-IR)来提高光谱的分辨率,再利用二维相关红外光谱(2D-IR)通过温度微扰来研究各组分基团分子的振动行为差异,揭示各官能团之间的相互作用,简化复杂光谱的重叠峰[12-13]的方法。傅里叶变换红外光谱、二维相关红外光谱技术已广泛应用在中草药鉴定方面[14],傅里叶变换红外光谱技术、近红外光谱技术也被广泛应用于农作物种子的鉴定:Jia等[15]利用近红外光谱技术鉴定涂料玉米种子;Ambrose等[16]利用近红外和拉曼光谱技术测量比较玉米种子的活力;Lu等[17]利用傅里叶变换红外光谱和光声光谱(PAS)技术对不同品种的油菜籽进行分类;Kandpal等[18]利用近红外高光谱成像系统结合多元统计分析研究甜瓜种子的生存能力和活力;Ambrose等[19]利用高光谱成像技术测量玉米种子的活力;Chen等[20]利用傅里叶变换红外光谱与二维相关红外光谱相结合的技术测定大青种子的化学变化。本文应用红外光谱三级鉴别法(FT-IR、SD-IR、2D-IR相结合的方法),鉴别不同储藏年份的3种豆类种子,为鉴别种子的老化提供参考。
2 实验
2.1 仪器设备
实验选用美国PerkinElmer公司生产的Frontier型傅里叶变换红外光谱仪,配备DTGS探测器,测定范围为4000~400 cm-1,分辨率为4 cm-1,累计扫描16次。采用EUROTHERM公司生产的SYD-TC-01型温度控制仪,温度控制在50~120 ℃范围内,升温速率为2 ℃/min,每隔10 ℃采集一次光谱,温度为24 ℃,相对湿度为28%。
2.2 样品采集及检测
实验用蚕豆、大豆、红菜豆均采自云南省陆良县,均在2013年收集并于室温(温度为24 ℃,相对湿度为27%)下储藏,并且样品一直储藏在固定的地方。每年11月份都对样品进行测量,3种样品每次各测试10个样品。实验时,将样品放入玛瑙研钵中磨成细粉,再加入适量的溴化钾搅磨均匀(1 mg样品与100 mg溴化钾混合研磨),制成压片,然后测试光谱,所测光谱均扣除纯溴化钾背景。
2.3 光谱处理和数据分析
使用红外光谱处理软件(OMNIC 8.2)对所采集的原始光谱进行基线校正、平滑、纵坐标归一化、平均谱图及平滑点数为5的Savitsky-Golay二阶导数预处理。利用Origin 8.6软件对10次测量值的平均红外光谱的原始光谱和二阶导数红外光谱数据进行处理,使用清华大学分析中心编制的二维相关分析软件(TD 4.2软件)对动态谱进行同步相关红外光谱分析,利用SPSS软件进行方差分析,再利用SIMCA(soft independent modelling of class analogy)软件进行偏最小二乘法分析。
3 实验结果
3.1 种子的红外光谱特征
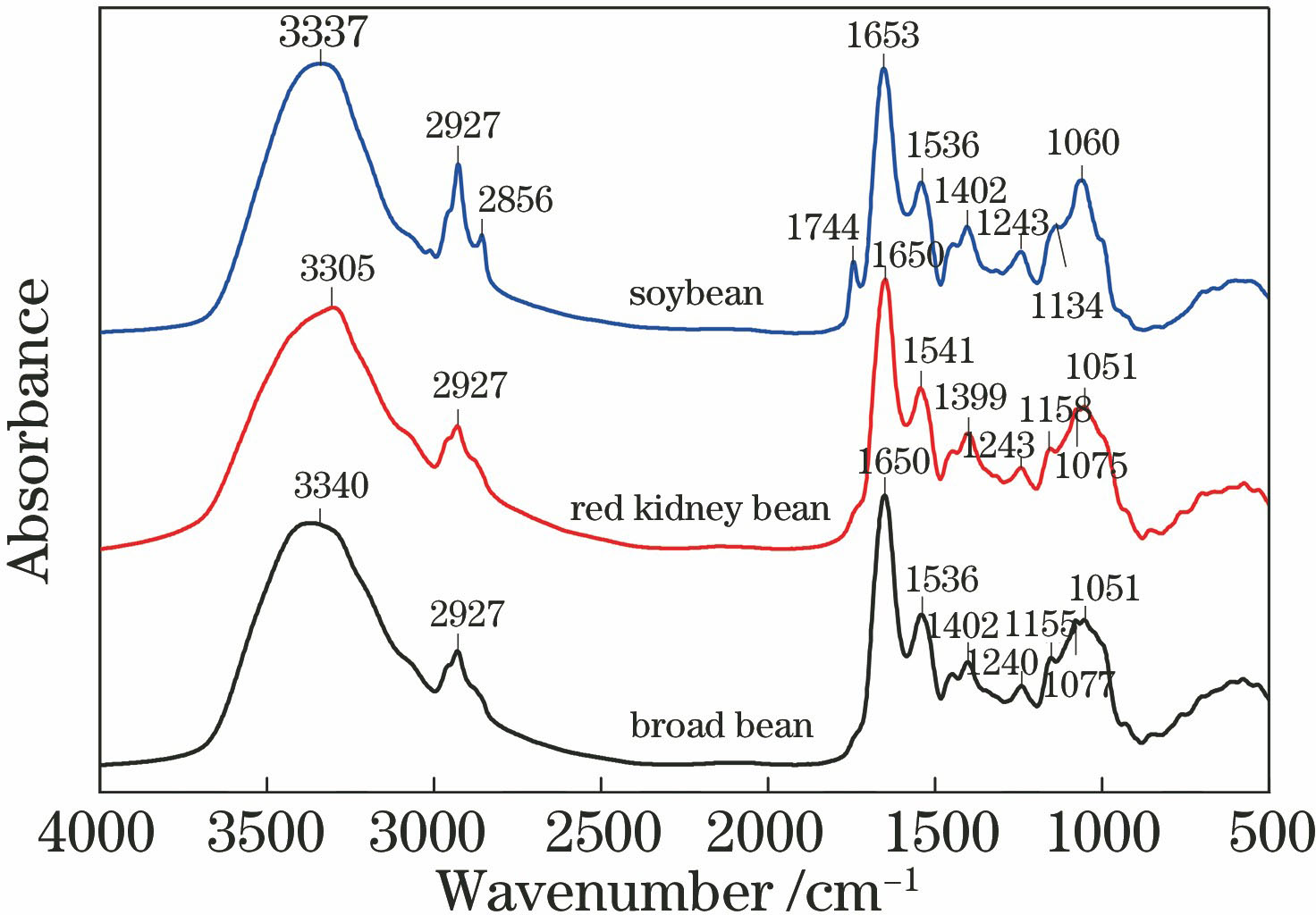
在1500~1200 cm-1范围内的峰为蛋白质、脂肪酸和多糖的混合振动吸收区,在1155,1075,1051 cm-1附近的弱吸收峰为蛋白质、多糖等分子的C-O伸缩振动[21],在950 cm-1指纹区以下是蛋白质和碳水化合物的N-H和O-H的面外弯曲振动及碳水化合物中糖环振动的重叠峰[23-24]。可以看出,3种豆类种子的红外光谱主要由蛋白质及碳水化合物的吸收峰组成。
比较不同储藏年份的3种豆类种子的原始红外光谱(

图 2. 不同储藏年份的3种豆类种子的傅里叶变换红外光谱。(a)蚕豆种子;(b)红菜豆种子;(c)大豆种子
Fig. 2. FT-IR spectra of three kinds of legume seeds with different storage years. (a) Broad bean seeds; (b) red kidney bean seeds; (c) soybean seeds
3.2 单因素方差分析
进一步利用吸收强度比(
表 1. 单因素方差分析计算结果
Table 1. Results for one-way analysis of variance
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3 二阶导数红外光谱分析
在原始红外光谱的基础上,通过二阶导数红外光谱提高光谱的分辨率进行区分。由

图 3. 不同储藏年份的3种豆类种子在1800~700 cm-1范围内的二阶导数红外光谱。(a)蚕豆种子;(b)红菜豆种子;(c)大豆种子
Fig. 3. SD-IR spectra of three kinds of legume seeds with different storage years in the range of 1800-700 cm-1. (a) Broad bean seeds; (b) red kidney bean seeds; (c) soybean seeds
3.4 二维相关红外光谱分析
二维相关红外光谱通过引入外界微扰来研究各组分基团分子振动行为的差异,将传统红外光谱信号扩展到二维上来提高光谱的分辨率,简化复杂光谱的重叠峰,提供更多的细节信息[26]。对3种不同储藏年份的豆类种子进行二维相关红外光谱处理,得到二维相关同步谱的等高线图及自动峰图谱。
由
由
由
据以上针对3种豆类种子二维相关红外光谱的分析可以得出,不同储藏年份的豆类种子的自动峰和交叉峰的位置、数目及强度存在显著差异,随着储藏年份增加,自动峰和交叉峰的数目减少,强度减弱。利用这一特点可以实现对不同储藏年份3种豆类种子的鉴别。

图 4. 不同储藏年份的3种豆类种子在860~1690 cm-1范围的二维相关红外光谱。(a)蚕豆种子;(b)红菜豆种子;(c)大豆种子
Fig. 4. 2D-IR spectra of three kinds of legume seeds with different storage years in the range of 860-1690 cm-1. (a) Broad bean seeds; (b) red kidney bean seeds; (c) soybean seeds
3.5 偏最小二乘法分析
SIMCA分类法是基于主成分分析的有监督模式的识别方法,它根据一组已知分类的训练集样本分别建立每一个类的主成分模型,在进行模式识别时,不同模型之间有足够的距离,所以不同模式之间存在显著差别[27]。设光谱数据为自变量
以上说明,偏最小二乘法能快速对不同储藏年份的种子进行分类。

图 5. 不同储藏年份的3种豆类种子的二阶导数光谱在1800~800 cm-1范围的偏最小二乘法分析结果。(a)蚕豆种子;(b)红菜豆种子;(c)大豆种子
Fig. 5. PLS-DA of the second derivative spectra in the range of 1800-800 cm-1 for three kinds of legume seeds with different storage years. (a) Broad bean seeds; (b) red kidney bean; (c) soybean seeds
4 分析与讨论
目前,研究人员对种子老化的研究主要集中在生理生化方面。研究结果显示,在种子老化过程中,种子活力下降,发芽率、发芽势指数较低,蛋白质等合成能力下降,干重减少,形状被破坏,有毒有害物质累积[29]。Daniel等[11]利用微卫星标记方式对番茄种子衰老过程中的遗传完整性进行评价,得出了番茄种子在衰老过程中遗传完整性下降这一结论。光谱技术也可用于种子的测定,如袁贝等[30]利用GC-MS测定了新、陈大米中脂肪酸的含量,结果发现陈米中的多不饱和脂肪酸质量分数降低,饱和脂肪酸质量分数上升;利用电子鼻方法检测新、陈大米的气味后发现两者差异明显,利用红外光谱分析发现大米陈化后的脂肪酸特征吸收峰在1745,1149,1017 cm-1附近的强度明显降低。李美凌等[31]基于高光谱图像研究了水稻种子的活力,得出了不同老化程度的水稻种子的光谱曲线有一定差异的结论。Ambrose等[16]利用近红外和拉曼光谱对玉米种子的活力进行了检测,并比较了两种方法对玉米种子活力测试及分类的优劣,得出近红外光谱测试玉米种子活力优于拉曼光谱技术的结论。本课题组利用傅里叶变换红外光谱研究种子老化期间光谱的变化规律,以区分不同储藏年份的豆类种子。研究结果显示:在原始光谱中,不同储藏年份种子的几个吸收强度比随储藏年份增加总体呈下降的趋势;进一步进行方差分析后发现,不同储藏年份的种子的吸收强度比有显著差异;偏最小二乘分析法能快速地对不同储藏年份的种子进行分类。不同储藏年份种子的二阶导数红外光谱显示出更明显的差异,在二维相关红外光谱中,不同储藏年份的种子的自动峰和交叉峰出现的数目及强度存在显著差异,随储藏年份增加,自动峰的数目减少,强度减弱。二维相关红外光谱技术有效地揭示出老化种子之间的差异,且优于傅里叶变换红外光谱的原始红外光谱和二阶导数红外光谱。利用红外光谱三级鉴别技术鉴别自然老化豆类种子具有简便、快速和有效的特点。但本研究样品数量有限,有必要进行深入研究,测试不同种类的样品,以探寻光谱变化的一般规律,为种子自然老化的振动光谱鉴别提供参考。
5 结论
本课题组运用傅里叶变换红外光谱、二阶导数红外光谱和二维相关红外光谱对自然老化豆类种子进行鉴别,结果显示:3种豆类种子的原始光谱主要由蛋白质及碳水化合物的吸收峰组成,在不同储藏年份的种子的光谱中,各个吸收峰差异微小,但吸收强度比存在一定差异;方差分析显示不同储藏年份种子的吸收强度比有显著差异,偏最小二乘法能对不同储藏年份的种子进行分类。在二阶导数光谱中,不同储藏年份的种子在1800~700 cm-1范围内的光谱存在明显差异。二维相关红外光谱显示:不同储藏年份的3种豆类种子的自动峰和交叉峰的数目随储藏年份的增加而减少,强度随储藏年份的增加而减弱。实验结果表明,利用红外光谱技术可以对不同储藏年份的豆类种子进行简单、有效的鉴别。
[1] Moncaleano-Escandon J. Silva B C F, Silva S R S, et al. Germination responses of Jatropha curcas L. seeds to storage and aging[J]. Industrial Crops and Products, 2013, 44: 684-690.
[2] 陈玲玲, 程航, 张阳阳, 等. 不同贮藏年限敖汉苜蓿种子活力及生理特性的研究[J]. 种子, 2017, 36(3): 23-27, 32.
[3] Darrudi R, Hassandokht M R, Nazeri V. Effects of moist stratification,GA3 and seed age on seed germination of Rheum khorasanicum B. Baradaran & A. Jafari[J]. Journal of Applied Research on Medicinal and Aromatic Plants, 2015, 2(4): 168-173.
[6] Dhivya K, Vengateswari G, Arunthirumeni M, et al. Bioprospecting of Prosopis juliflora (Sw.) DC seed pod extract effect on antioxidant and immune system of Spodoptera litura (Lepidoptera: Noctuidae)[J]. Physiological and Molecular Plant Pathology, 2018, 101: 45-53.
[10] 李加国, 李松林, 韩梅, 等. 4种检测柠条种子活力技术的比较分析[J]. 北京林业大学学报, 2015, 37(1): 15-21.
[12] 于海超, 刘刚, 欧全宏, 等. 月季花叶片的二维相关红外光谱研究[J]. 激光与光电子学进展, 2016, 53(5): 053003.
[13] 吕慧茹, 欧全宏, 刘刚, 等. 不同品质宣威火腿的傅里叶变换红外光谱研究[J]. 光学学报, 2015, 35(s2): s230004.
[21] 李会梅, 刘刚, 欧全宏, 等. 8种豆的二维相关红外光谱的分析[J]. 激光与光电子学进展, 2016, 53(3): 033003.
[25] 刘伟涛, 李萍, 李德豪, 等. 方差分析数据处理系统的设计[J]. 计算机与应用化学, 2015, 32(5): 583-586.
[26] Xiang L, Wang J J, Zhang G J, et al. Analysis and identification of two similar traditional Chinese medicines by using a three-stage infrared spectroscopy: Ligusticum chuanxiong, Angelica sinensis and their different extracts[J]. Journal of Molecular Structure, 2016, 1124: 164-172.
[27] 杨天伟, 李涛, 李杰庆, 等. 不同年份和产地美味牛肝菌的红外光谱鉴别研究[J]. 光谱学与光谱分析, 2016, 36(7): 2117-2123.
[28] 李四海, 潘新波, 任真, 等. 不同生长期当归红外光谱的偏最小二乘分析[J]. 中国实验方剂学杂志, 2013, 19(12): 132-135.
[29] 孙常玉, 陈晓, 张志鹏, 等. 种子老化对小麦种子品质的影响[J]. 种子, 2015, 34(8): 88-90.
[30] 袁贝, 邵亮亮, 张春丹, 等. 基于多种分析方法解析新陈大米的品质特性[J]. 中国粮油学报, 2016, 31(8): 1-5, 29.
[31] 李美凌, 邓飞, 刘颖, 等. 基于高光谱图像的水稻种子活力检测技术研究[J]. 浙江农业学报, 2015, 27(1): 1-6.
Article Outline
杨卫梅, 刘刚, 欧全宏, 安冉, 符致秋, 李建美, 时有明. 豆类种子自然老化过程的红外光谱研究[J]. 激光与光电子学进展, 2018, 55(12): 123001. Weimei Yang, Gang Liu, Quanhong Ou, Ran An, Zhiqiu Fu, Jianmei Li, Youming Shi. Infrared Spectroscopy of Naturally Aged Legume Seeds[J]. Laser & Optoelectronics Progress, 2018, 55(12): 123001.