pH响应型BSA-GMA 3D水凝胶结构的飞秒激光直写  下载: 633次【增强内容出版】
下载: 633次【增强内容出版】
1 引言
刺激响应型材料具有广阔的应用前景,包括软机器人、柔性电子器件、致动器、生物医学设备和药物递送等[1-5]。许多智能材料已被广泛应用于四维(4D)打印,包括液晶弹性体、形状记忆聚合物和刺激响应型水凝胶等[6-8]。牛血清白蛋白(BSA)作为天然蛋白之一,由于其低成本、无毒、生物降解性、生物相容性、刺激响应特性以及与人血清白蛋白相似的性质,已被广泛研究[9-10]。值得注意的是,基于BSA的动态可调和响应迅速的“智能”三维(3D)微结构具有明确的几何形状和可重复性,对于再生医学和组织工程至关重要。
在体内生物医学与药物递送应用中,人们希望器件具有微纳米级的尺寸[11-12]。为了更好地满足合成的微观结构在规模和精度上的不同需求,研究者开发了多种微制造技术来构建三维(3D)水凝胶,如立体光刻技术[13]、软光刻技术[14-15]、数字光投影技术[16-20]、电子束光刻[21-22]和生物打印技术[23]。然而,高效制备任意形状且具有高分辨率的三维结构仍是一项挑战[24]。双光子聚合(TPP)作为一种飞秒激光直写技术,可将透明聚合物溶液快速聚合成任意形状的高分辨率3D微结构,已广泛应用于微纳光子学[25]、微流控[26]、组织工程[27-31]和药物递送[32-34]等领域[32, 35-37]。
本课题组前期自主合成了一系列基于BSA的甲基丙烯酸缩水甘油酯(GMA)酸化的BSA-GMA生物材料[38],发现其具有更好的双光子聚合特性。本研究重点探索了利用飞秒激光直写制备3D水凝胶微结构及其pH响应性和生物相容性。首次全面研究了具有不同浓度和甲基丙烯酸化度的宏观与3D微结构的BSA-GMA的pH响应能力,以及BSA-GMA 3D水凝胶微结构的生物相容性。研究结果表明,BSA-GMA水凝胶的浓度越大或甲基丙烯酸化度越小,BSA-GMA的pH响应程度越大。因为BSA-GMA材料的双光子聚合发生在GMA链上的C=C处,因此可以通过改变甲基丙烯酸化程度进一步改变交联密度,并且双光子聚合过程不消耗氨基酸基团,使得BSA-GMA材料的pH响应能力和三维结构的稳定性均比BSA水凝胶的更好。BSA-GMA水凝胶具有pH响应的原因是BSA上的氨基和羧基在不同pH条件下的质子化和电离导致的静电排斥作用。由于改性过程中,一个赖氨酸基团可以接枝两个GMA基团,提高了接枝效率,在后续的飞秒激光直写双光子聚合中BSA-GMA的交联密度得到提高,因此BSA-GMA材料可以制备出更稳定的3D微结构。共聚焦荧光图像与细胞的增殖结果表明,BSA-GMA水凝胶无细胞毒性,有利于细胞的黏附与增殖。这种具有可调的pH响应性、良好生物相容性和精细3D结构的蛋白质水凝胶在生物医学领域具有广泛的应用潜力。
2 实验部分
2.1 实验试剂与仪器
本研究中用到的主要试剂包括:BSA-GMA(自主合成;苯基(2,4,6-三甲基苯甲酰基)磷酸锂(LAP)(TCI发展有限公司,日本);盐酸(HCl)和氢氧化钠(NaOH)(现代东方(北京)科技发展有限公司,中国);磷酸盐缓冲溶液(PBS)(pH=7.4)(北京雷根生物技术有限公司,中国);兔关节软骨细胞和兔关节软骨细胞完全培养基(武汉普诺赛生命科技有限公司,中国);Hoechst 33342(北京索莱宝科技有限公司,中国);Mito-Tracker Deep Red(Invitrogen公司,英国)。
仪器主要包括:Zetasizer粒度电位仪(Nano ZS90,马尔文公司,英国);飞秒激光器(ErFemto-780 ProH,中国)、振镜(SCANLAB, HurrySCAN14,德国)、压电位移台(PI,P-622.ZCL,德国);Eclipse Ti-E显微镜和CCD DS-Ri2(尼康,日本);场发射扫描电子显微镜(FESEM,HITACHI S-4800,日本);激光扫描共聚焦荧光显微镜(A1 MP,尼康,日本);酶标仪(Multiskan fc,Thermo scientific,美国)。
2.2 BSA-GMA前驱体溶液的制备
首先,将质量分数0.5%的光引发剂LAP和甲基丙烯酸化度为52%的冻干BSA-GMA粉末以不同浓度溶解在超纯水中,分别形成质量分数20% BSA-GMA(52%)、30% BSA-GMA(52%)和40% BSA-GMA(52%)的前驱体溶液。然后,在超纯水中加入甲基丙烯酸化度为35%和15%的BSA-GMA粉末以及质量分数0.5%的光引发剂LAP,形成质量分数40% BSA-GMA(35%)、40% BSA-GMA(15%)前驱体溶液。

图 1. BSA-GMA前驱体溶液各组分的分子结构示意图
Fig. 1. Molecular structures of monomer and photoinitiator for BSA-GMA precursors
表 1. 制备的光刻胶前驱体溶液的主要成分
Table 1. Main components of the as-prepared photoresist precursors
|
2.3 Zeta电位表征
在不同的pH条件下,使用Zetasizer粒度电位仪对BSA以及改性后不同甲基丙烯酸化度的BSA-GMA的电特性进行了表征。磷酸氢二钠-柠檬酸(Na2HPO4-CA)缓冲溶液的pH值分别为4.71、5.30和5.86。将BSA和三种BSA-GMA粉末以质量浓度10 μg·mL-1溶解在不同pH值的Na2HPO4-CA缓冲溶液中,并表征不同样品的Zeta电位值。等电点数值是Zeta电位为0 mV时的pH值,通过跨越0 mV的两个pH值的线性拟合得到。
2.4 宏观BSA-GMA水凝胶的pH响应表征
首先,使用紫外光聚合制备了一系列的宏观BSA-GMA水凝胶圆片,拍照记录水凝胶结构并称重(W0)。然后,在室温下将200 μL不同pH的溶液滴在含有水凝胶结构的盖玻片上,在装有CCD DS-Ri2和50×物镜(NA为 0.8)的显微镜下记录pH响应过程。pH响应实验分别在pH 2、pH 5、pH 7和pH 11的溶液中进行,其中不同pH的溶液是由浓HCl和NaOH配制。再将水凝胶结构依次浸泡在pH 5、pH 7、pH 2和pH 11的溶液中,达到溶胀平衡后对水凝胶结构拍照记录并称重(Wt)。重复这一过程以获得一系列数据。按照下式,计算不同BSA-GMA水凝胶结构在不同pH溶液中的溶胀百分比(%),以评估BSA-GMA水凝胶的宏观pH响应能力。
2.5 飞秒激光直写制备BSA-GMA 3D水凝胶微结构
飞秒激光直写系统由飞秒激光器、扫描振镜、单轴压电位移台、中性密度滤光片、快门、扩束透镜组、反射镜和计算机等组成。飞秒激光的中心波长为780 nm、脉冲持续时间为150 fs、重复频率为100 MHz。飞秒激光经扩束整形后入射到扫描振镜中,出射的飞秒激光通过4f成像系统后被60×油浸物镜聚焦到移动台上的BSA-GMA前驱体溶液中。机械快门用于控制曝光时间。中性密度滤光片用于调节飞秒激光的功率,以选择合适的功率制造微结构。照明光源的光经待加工样品及物镜后被CCD接收,以实现微纳结构加工过程的实时观察与监测。激光束的扫描路径由振镜控制,然后根据设计图形逐层扫描制作。最后经去离子水显影处理后得到水凝胶微结构。使用S-4800扫描电子显微镜记录BSA-GMA水凝胶微结构的电子显微图像。
2.6 BSA-GMA 3D水凝胶微结构的pH响应表征
首先,利用飞秒激光聚合制备了高为8 μm、直径为3 μm的圆形底座的3D悬浮微结构的BSA-GMA 水凝胶。然后,在室温下分别将200 μL 的pH 2、pH 5、pH 7和pH 11溶液依次滴在含有水凝胶结构的盖玻片上,并在装有CCD DS-Ri2和50×物镜(NA为 0.8)的Eclipse Ti-E显微镜上记录pH响应的明场图像。空气中的结构面积记录为S0,不同pH溶液中的溶胀面积记录为Sp。微观pH溶胀率的计算公式为
2.7 BSA-GMA 水凝胶结构对细胞活性的影响
首先,利用飞秒激光直写技术制备浓度和取代度最大的R40D52体系的3D细胞支架结构,用体积分数75%的乙醇和紫外线分别灭菌1 h。随后,将兔关节软骨细胞与细胞支架结构在37 °C和体积分数5% CO2的加湿培养箱中共培养72 h。活细胞线粒体使用Mito-Tracker Deep Red染色20 min,活细胞核使用Hoechst 33342染色10 min。荧光图像使用共聚焦荧光显微镜和20×物镜观察。激发波长分别为405 nm、488 nm和640 nm。
2.8 BSA-GMA浸提液中软骨细胞的增殖
首先,利用紫外光聚合制备BSA-GMA水凝胶圆片,灭菌后在兔关节软骨细胞完全培养基中加入BSA-GMA水凝胶圆片,24 h后得到质量浓度为0.1 g·mL-1浸提液。然后在96孔板中设置空白组、对照组和测试组来培养细胞,并且各加入100 μL兔关节软骨细胞完全培养基培养一天。空白组无细胞,对照组和测试组每孔加入2500个细胞。随后,将水凝胶浸提液加入测试组(每孔100 μL),而空白组和对照组则在96孔板中继续加入100 μL兔关节软骨细胞完全培养基。培养基每天更换。在1、7和14天时,在每个孔中加入150 μL的CCK-8和培养基的混合溶液(10% CCK-8),孵育2~4 h。随后,使用波长为450 nm的酶标仪测得各孔的吸光度,空白组、对照组和测试组的吸光度分别为AODb、AODc和AODt。相对细胞增长率的计算公式为
3 分析与讨论
3.1 宏观BSA-GMA水凝胶的pH响应
蛋白质由于含有大量的羧酸基团和氨基基团,因此具有随pH响应而改变自身体积的能力[9-10, 39]。BSA水凝胶具有pH响应特性,但为了验证改性是否会对pH响应性产生影响,本研究使用粒度电位仪测量了在不同的pH条件下BSA和甲基丙烯酸化度分别为15%、35%和52%的BSA-GMA样品(简称为D15、D35和D52)的电学性质,并拟合得到等电点数值。如

图 2. BSA和不同甲基丙烯酸化度的BSA-GMA(D15、D35和D52)材料的电学性质。(a)BSA和不同甲基丙烯酸化度BSA-GMA材料的Zeta电位;(b)BSA和不同甲基丙烯酸化度的BSA-GMA材料的等电点
Fig. 2. Electrical properties of BSA and BSA-GMA materials with different degrees of methacrylation (D15, D35, and D52). (a) Zeta potentials of BSA and BSA-GMA with different degrees of methacrylation; (b) isoelectric points of BSA and BSA-GMA with different degrees of methacrylation
利用紫外光聚合制备了一系列的宏观BSA-GMA水凝胶结构,研究了不同单体浓度和甲基丙烯酸化度的宏观BSA-GMA水凝胶结构的pH响应能力(
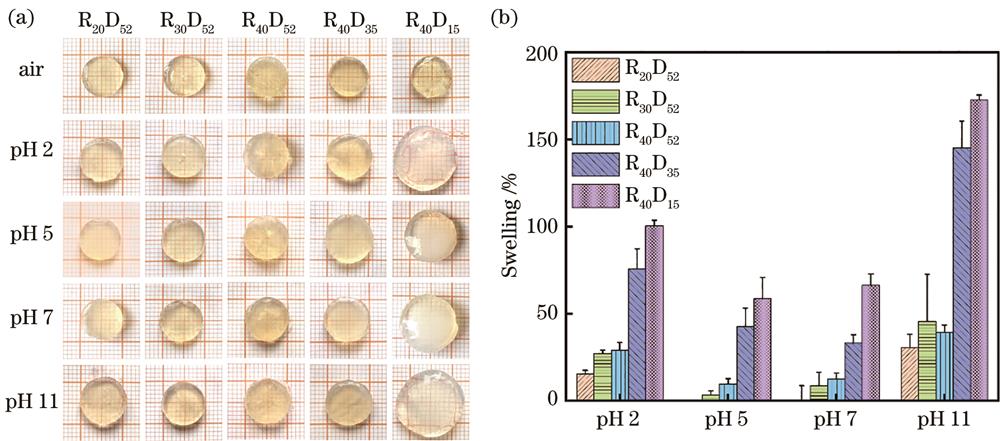
图 3. 不同浓度和甲基丙烯酸化度的BSA-GMA水凝胶的宏观pH响应特性。(a)不同pH溶液中5种BSA-GMA水凝胶的图像;(b)浓度和甲基丙烯酸化度对BSA-GMA水凝胶宏观pH响应的影响
Fig. 3. Macroscopic pH-responsive properties of BSA-GMA hydrogels with different concentrations and degrees of methacrylation. (a) Images of five BSA-GMA hydrogels in different pH solutions; (b) effect of concentration and degree of methacrylation of BSA-GMA hydrogels on the macroscopic pH response
3.2 飞秒激光直写制备的BSA-GMA3D水凝胶微结构的pH响应
为了进一步研究BSA-GMA材料的微观pH响应性与生物相容性,本研究采用自主搭建的双光子聚合振镜加工系统制备所需要的BSA-GMA 3D水凝胶微结构[

图 4. 微观pH响应性的BSA-GMA水凝胶微结构的设计与制造示意图。(a)飞秒激光直写系统示意图;(b)微观pH响应的BSA-GMA悬浮结构的响应机制示意图
Fig. 4. Schematic design and fabrication of pH-responsive BSA-GMA hydrogel microstructures. (a) Schematic diagram of the femtosecond laser direct writing system; (b) schematic diagram of the response mechanism of the pH-responsive suspended BSA-GMA structures
为了评估飞秒激光直写制备的BSA-GMA水凝胶的微观结构的pH响应特性,研究不同pH条件下的可逆膨胀,设计了悬浮式的3D水凝胶微结构,其中,与基板接触的是底部高为8 μm和直径为3 μm的圆柱。以R20D52、R30D52、 R40D52、R40D35与R40D15 为前驱体制备3D悬浮微结构所采用的加工功率分别为34.8、10.1、9.8、14.9、15.0 mW,扫描速度均为110 μm·s-1。BSA-GMA水凝胶的悬浮微结构的扫描电镜(SEM)图像如

图 5. 飞秒激光直写制备的BSA-GMA悬浮水凝胶微结构的pH响应特性。(a)飞秒激光直写制备的BSA-GMA水凝胶悬浮微结构的SEM图;(b)在空气中BSA-GMA悬浮微结构的明场图像;(c)~(f)在不同pH溶液中BSA-GMA悬浮微结构的溶胀行为的明场图像
Fig. 5. pH-responsive properties of suspended BSA-GMA hydrogel microstructures fabricated by femtosecond laser direct writing. (a) SEM images of suspended BSA-GMA hydrogel microstructures fabricated by femtosecond laser direct writing; (b) bright field images of suspended BSA-GMA microstructures in air; (c)‒(f) bright field images of swelling behavior of suspended BSA-GMA microstructures in different pH solutions
通过量化不同pH条件下的不同BSA-GMA悬浮微结构的溶胀率,研究了单体浓度与甲基丙烯酸化度对水凝胶微结构pH响应的影响[

图 6. BSA-GMA悬浮水凝胶微结构的pH响应特性以及循环性能。(a)不同pH溶液中浓度和甲基丙烯酸化度对水凝胶微结构溶胀率的影响;(b)水凝胶微结构的可逆溶胀行为
Fig. 6. pH-responsive and cycling properties of suspended BSA-GMA hydrogel microstructures. (a) Influence of concentration and methacrylation on the swelling degree of the hydrogel microstructures in different pH solutions; (b) reversible swelling behavior of hydrogel microstructures
3.3 BSA-GMA水凝胶的生物相容性
应用于组织工程或药物递送的生物材料应具有良好的生物相容性[44]。为了验证BSA-GMA水凝胶在组织工程与药物递送领域的可行性,通过软骨细胞染色的共聚焦荧光图像以及CCK-8实验表征了BSA-GMA水凝胶的生物相容性。使用R40D52的前驱体溶液制备的3D细胞支架的俯视和斜视SEM图像如

图 7. BSA-GMA 3D水凝胶细胞支架结构及其软骨细胞共培养的共聚焦荧光图像。(a)飞秒激光直写制备的3D细胞支架结构SEM俯视图;(b)飞秒激光直写制备的细胞支架结构SEM斜视图;(c)细胞核(Hoechst)染色的共聚焦荧光图像;(d)细胞支架结构的共聚焦荧光图像;(e)线粒体(Mito-Tracker Deep Red)染色的共聚焦荧光图像;(f)BSA-GMA细胞支架结构上的软骨细胞的共聚焦荧光叠加图像
Fig. 7. BSA-GMA 3D cell scaffold and the confocal fluorescence microscopy images of chondrocytes. (a) SEM top view of the 3D cell scaffold fabricated by femtosecond laser direct writing; (b) SEM oblique view of the 3D cell scaffold fabricated by femtosecond laser direct writing; (c) confocal fluorescence microscopy image of the nucleus (Hoechst); (d) confocal fluorescence microscopy image of the cell scaffold; (e) confocal fluorescence image of the mitochondria (Mito-Tracker Deep Red); (f) overlayed confocal fluorescence image of chondrocytes on BSA- GMA cell scaffolds
通过CCK-8测试检测了在R40D52水凝胶浸提液中培养的软骨细胞的增殖情况,所采用的激发波长是450 nm。随着细胞与浸提液共培养时间的增长,细胞数量逐渐增加,水凝胶组和对照组细胞的生长趋势相当[

图 8. 利用CCK-8表征的BSA-GMA水凝胶浸提液中软骨细胞的增殖情况。(a)在第1、7和14天对照组和BSA-GMA水凝胶浸提液中培养的软骨细胞的增殖情况;(b)水凝胶浸提液中培养的细胞的相对增长率
Fig. 8. Proliferation of chondrocytes in BSA-GMA hydrogel extract by CCK-8 characterization. (a) Proliferation of chondrocytes cultured in control and BSA-GMA hydrogel extract on 1st, 7th, and 14th days; (b) relative cell growth rate of hydrogel extracts
4 结论
本工作详细研究了BSA改性后的BSA-GMA 水凝胶的宏观pH响应特性、利用飞秒激光直写的BSA-GMA 3D水凝胶微结构的pH响应特性、pH响应机理以及BSA-GMA水凝胶微结构的生物相容性。BSA与BSA-GMA材料等电点表征结果显示,BSA-GMA材料的等电点与BSA相当,具有pH响应特性。通过飞秒激光直写聚合得到的一系列不同浓度和甲基丙烯酸化度的BSA-GMA 3D悬浮微结构的pH研究表明,BSA-GMA水凝胶具有明显优于BSA水凝胶的3D微结构和pH响应能力。对于同一pH条件下,浓度越大或甲基丙烯酸化度越小,BSA-GMA 3D水凝胶微结构溶胀程度越大。本研究还揭示了BSA-GMA水凝胶在不同pH条件下溶胀程度不同的机理,主要是由于BSA中含有的羧酸基团和氨基基团在不同pH条件下的质子化或电离导致的静电排斥作用。在pH<5时,氨基质子化使BSA-GMA带正电,当pH>5时,羧酸的电离使BSA-GMA带负电荷,氨基酸之间的静电作用产生的排斥力使得聚合物网络扩大。软骨细胞在BSA-GMA支架上的共聚焦荧光图像和相对细胞增长率研究结果表明,BSA-GMA水凝胶具有良好的生物相容性。这种具有可控形态和pH响应特性的蛋白质微结构在组织工程、生物医学和生物传感器领域具有潜在的应用前景。
[16] 周子逸, 董贤子, 郑美玲. 数字微镜无掩模光刻技术进展及应用[J]. 激光与光电子学进展, 2022, 59(9): 0922030.
[17] 高文, 郑美玲, 金峰, 等. 飞秒激光快速制备大面积二维微纳结构[J]. 激光与光电子学进展, 2020, 57(11): 111421.
[24] 郭敏, 刘享洋, 董贤子, 等. 曲线型微纳拓扑结构的制备及细胞行为调控[J]. 中国激光, 2023, 50(15): 1507303.
[35] 赵圆圆, 金峰, 董贤子, 等. 飞秒激光双光子聚合三维微纳结构加工技术[J]. 光电工程, 2023, 50(3): 220048.
[36] 张维彩, 郑美玲. 高效双光子引发剂及水相中制备水凝胶微结构的研究进展[J]. 中国激光, 2021, 48(2): 0202007.
[37] 武昕宜, 段琦, 宾凡淳, 等. 飞秒激光双光子聚合制备3D水凝胶微结构及其应用[J]. 中国激光, 2023, 50(21): 2107401.
Article Outline
李腾, 武昕宜, 段琦, 宾凡淳, 牛梦瑶, 郑美玲. pH响应型BSA-GMA 3D水凝胶结构的飞秒激光直写[J]. 激光与光电子学进展, 2024, 61(21): 2114007. Teng Li, Xinyi Wu, Qi Duan, Fanchun Bin, Mengyao Niu, Meiling Zheng. Fabrication of pH-Responsive BSA-GMA 3D Hydrogel Structures via Femtosecond Laser Direct Writing[J]. Laser & Optoelectronics Progress, 2024, 61(21): 2114007.







