白细胞对偏振光的散射特性及散射特性与细胞结构的关系  下载: 963次
下载: 963次
1 引言
白细胞是抵御病原入侵、制造抗体、疾病免疫的重要成分,其核象变化是临床诊断和免疫研究最重要的指标之一。由于现有的流式技术将细胞简化为单球模型,利用散射信号仅能反演细胞粒径的大小,因此必须依赖细胞染色后获得的荧光信号才能实现白细胞的五分类,导致在使用时需对细胞进行裂解和固着,并选择与光源、细胞蛋白相匹配的染色剂,增加了样品制备的难度和使用成本。
为了使流式技术中的散射信号广泛应用于白细胞分类识别,人们对复杂血细胞的散射特性展开了研究。Eremina等[1]采用离散信息源法(DSM),基于均质椭球模型模拟了红细胞的散射强度分布。Tsinopoulos等[2]采用边界元法(BEM),基于介电圆柱体模型数值模拟了红细胞的散射强度分布。王亚伟等[3]利用瑞利-德拜-甘斯(RDG)近似,得到了基于同心双椭球模型的白细胞散射强度分布与特征量变化下的动态响应关系。Mourant等[4]通过测量细胞悬浮液的约化散射系数和散射相位函数,证明了单细胞线粒体在大散射角度时影响细胞的光散射特性。Arifler等[5]采用三维椭球模型,运用时域有限差分方法模拟了4种宫颈细胞的散射,指出原位癌细胞散射更强且深度依赖上皮深度。随着美国Abbott公司的多角度偏振光散射(MAPSS)技术专利在五分类血细胞分析仪中的应用,基于偏振的光学技术在生物细胞诊断领域中越来越重要[6-10]。
本文基于偏振光的单粒子散射理论,利用几何光学近似(GOA)方法修正了偏振光传输的斯托克斯-穆勒矩阵元,采用白细胞的无粒偏心球模型,数值模拟了偏振化方向不同的线偏振光入射到具有不同几何参量和光学参量的白细胞时散射光强的空间分布,并对结果进行了分析。
2 偏心球模型、散射理论及修正方法
2.1 偏心球模型
白细胞中的淋巴细胞核为球形,其在细胞体积中所占比例大于60%,且为偏位,如
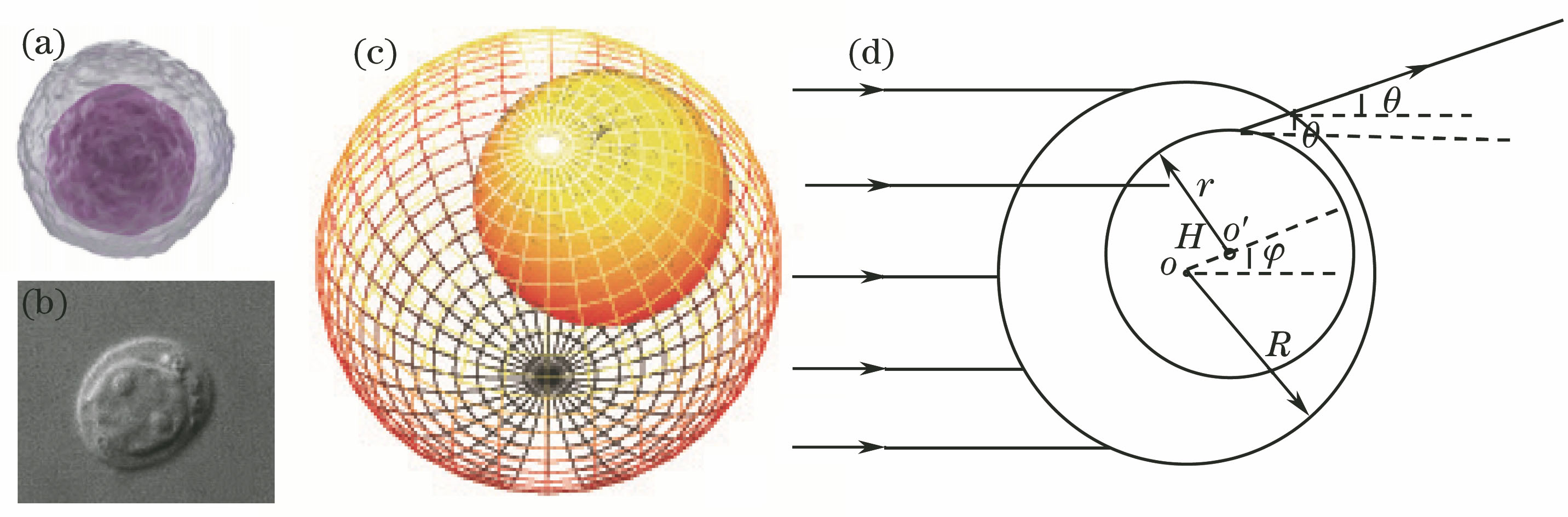
图 1. (a)染色的淋巴细胞;(b)未染色的单核细胞;(c)偏心球模型;(d)双层偏心球理论模型
Fig. 1. (a) Dyed lymphocyte; (b) undyed mononuclear; (c) eccentric sphere model; (d) theoretical model of double layer eccentric sphere
2.2 散射理论
在矩阵光学中,散射光与入射光之间的光矢量关系可由琼斯矩阵[11]变换得到:
式中1和2分别表示垂直于散射面和平行于散射面,
为了便于描述光的偏振特性,引入斯托克斯参量,结合穆勒矩阵与琼斯矩阵的关系和偏心球模型的对称性,可得
式中
式中
2.3 基于GOA法的偏心球散射振幅函数修正
Mie散射理论给出了散射振幅复函数
式中下标D表示衍射光,1,2表示垂直和平行方向,衍射在两方向上具有相同的形式,
经细胞质出射且不射入球核的光线的振幅函数为
入射角
调节悬浮液的折射率接近于细胞质的折射率,确保平行光垂直入射细胞核,且忽略散射光进入悬浮液时的偏转。细胞核的散射复振幅函数的衍射部分仍然由(4)式决定。与微粒的光学属性有关的部分为[14]
式中
其中Fresnel反射系数为
对于在细胞质间来回反射的光线,光强会随反射次数的增加而急剧下降,因此忽略其对散射光强的贡献。整个细胞的散射振幅函数为
式中
3 结果与讨论
3.1 模型与理论的可行性

图 2. 不同偏振模式入射时均质球的散射光强分布。(a)自然光;(b)垂直偏振光;(c)水平偏振光
Fig. 2. Scattering light intensity distributions of homogeneous ball with different polarization incidence modes. (a) Natural light; (b) vertical polarized light; (c) horizontal polarized light
利用2种方法论证模型和理论的可行性。首先,核质比为0时偏心球模型趋于均质球。用本文的修正理论计算自然光、垂直偏振光和水平偏振光入射时散射光强分布并与Mie散射理论对比,结果如
表 1. 淋巴细胞散射模型的参数设置
Table 1. Parameters in scattering models of lymphocyte
|
表 2. 数值计算结果与VirtualLab模拟结果对比
Table 2. Comparison of numerical results with VirtualLab simulation results
|
3.2 细胞形体模型对穆勒矩阵元的影响
分别采用偏心球模型和球模型计算单个淋巴细胞的穆勒矩阵,各几何参量和光学参量如

图 3. 不同散射模型中穆勒矩阵元素的对数分布。(a) M11;(b) M12;(c) M33;(d) M34
Fig. 3. Logarithmic distribution of Müller matrix elements in different scattering models. (a) M11; (b) M12; (c) M33; (d) M34
3.3 入射光偏振特性对散射光强分布的影响
分别将自然光、水平和垂直线偏振光、左旋和右旋圆偏振光的斯托克斯矢量代入(2)式,计算
由琼斯矢量可知,

图 4. 不同偏振模式入射时的散射光强分布
Fig. 4. Scattering light intensity distributions at different polarization incidence modes

图 6. 淋巴细胞散射光强随散射角和方位角的变化
Fig. 6. Variation of scattering light intensity with scattering angle and azimuth angle

图 7. 不同偏振模式入射时散射光强的相对分布
Fig. 7. Relative distribution of scattering light intensity at different polarization incidence modes
3.4 细胞核质比对散射光强分布的影响
在

图 8. 散射光强随散射角和核质比变化的对数分布。(a)水平线偏振光入射;(b)垂直线偏振光入射; (c)图8(a)与图8(b)结果的比值;(d)图8(a)与图8(b)结果的差值
Fig. 8. Logarithmic distributions of scattering light intensity varying with scattering angle and ratio of nuclear to cytoplasmic. (a) Horizontal linearly polarized light is incident; (b) vertical linearly polarized light is incident; (c) ratio of Fig. 8(a) result to Fig. 8(b) result; (d) difference between Fig. 8(a) result and Fig. 8(b) result
3.5 细胞粒径参量对散射光强分布的影响
细胞半径是影响粒径参量的一个因素。在

图 9. (a)水平线偏振光入射时散射光强随细胞半径变化的对数分布;(b)差和比
Fig. 9. (a) Logarithmic distribution of scattering light intensity varying with cell radius for horizontal linearly polarized light incidence; (b) ratio of difference to sum
入射光波长是影响粒径参量的另一个因素。

图 10. (a)不同波长水平偏振光入射时散射光强的对数分布;(b)差和比
Fig. 10. (a) Logarithmic distribution of scattering light intensity varying with wavelength for horizontal linearly polarized light incidence; (b) ratio of difference to sum
3.6 核质相对折射率对不同入射所得散射结果的影响
病变白细胞的折射率会发生变化,因此需要考虑其对散射结果的影响。在偏心球模型中,细胞质相对悬浮液的折射率接近于1才能保证平行光同时入射细胞和细胞核,因此只需要考虑细胞核相对细胞质的相对折射率变化对散射结果的影响。采取

图 11. (a)水平线偏振光入射时散射光强随散射角和相对折射率变化的对数分布;(b)差和比;(c)极大和极小位置
Fig. 11. (a) Logarithmic distribution of scattering light intensity varying with relative refractive index for horizontal linearly polarized light incidence; (b) ratio of difference to sum; (c) maximum and minimum positions of ratio
4 结论
根据白细胞的形体特点建立了无粒偏心球模型,运用GOA理论修正偏振光传输的斯托克斯-穆勒矩阵元。首先对不同入射光偏振模式的穆勒矩阵元进行数值计算,结果表明,不同偏振模式入射对细胞后向散射强度分布有影响,水平线偏振光和垂直线偏振光入射散射结果相差最大。其次模拟了白细胞在不同细胞核质比、细胞大小、细胞相对折射率时这2种偏振光入射的三维散射图谱,散射光强的指数均随散射角的增大而振荡变化,振荡频率随核质比的增大而减小,随细胞半径的增大而增大,不随相对折射率的增大而改变。最后去除衍射部分的影响,结果的数值分析表明2种入射的散射结果呈现不同的差异区间。1)当核质比变化时,2个结果的比值在散射角区间[0°,65°]时接近于1,但中间比值减小至0.8的区域随核质比的增大而扩大。当散射角在[65°,90°]区间时比值约为0.8,当散射角在[90°,180°]区间时比值减至小于0.6,且核质比越小,比值越小。2个结果的差值具有相同的区间分布,且在散射角约为60°时出现一个差值急剧变小的区域。2)当细胞粒径参量变化时,定义了2个结果的差和比。结果表明,当散射角在[0°,15°]区间时,差和比小于0.1且范围随粒径的增大而扩大;散射角在[15°,50°]区间时差和比约为0.2;散射角在[50°,65°]区间时差和比为0;散射角在[65°,90°]区间时,差和比在0.1~0.3之间随散射角和粒径参量振荡变化;散射角在[90°,180°]区间时差和比大于0.3,且随散射角的增大而振荡增大,粒径越小,增大越快。3)当相对折射率变化时,散射角在[0°,25°]区间时差和比小于0.1;散射角在[25°,90°]区间时差和比增大,且散射角变化区间随相对折射率的增大而扩大;散射角大于90°时,差和比进一步振荡增大,但与折射率无关联。同一相对折射率时,从前向大角度开始,差和比的极大位置随相对折射率的减小而向大角度移动;从侧向开始,极小位置随相对折射率的增大向大角度移动。
本文的研究为单细胞流式检测技术的光学方法提供了更多理论依据,从而为白细胞精细分类和病变细胞筛查提供了可挖掘的光学散射信息。这些现象的物理机制分析和实验验证是今后需要研究和解决的问题。
[3] 王亚伟, 卜敏, 崔青义, 等. 有核细胞光散射强度分布的动态特性[J]. 中国激光, 2006, 33(10): 1434-1439.
[5] AriflerD, MacAulay C, Follen M, et al. Numerical analysis of dysplasia-associated changes in depth-dependent light scattering profile of cervical epithelium[C]. SPIE, 2013, 8798: 879809.
[6] 丁驰竹, 杨克成, 李微, 等. 有核细胞对偏振光的散射强度分布[J]. 光学学报, 2013, 33(11): 1129001.
[9] 杜娥. 偏振散射特征定量检测与组织病变诊断机理研究[D]. 北京: 清华大学, 2014.
DuE. A study on quantitative polarization characterization of tissues for diagnosis applications[D]. Beijing: Tsinghua University, 2014.
[10] 屈檀, 吴振森, 韦尹煜, 等. 拉盖尔高斯涡旋光束对生物细胞的散射特性分析[J]. 光学学报, 2015, 35(s1): s129002.
[11] 廖延彪. 偏振光学[M]. 北京: 科学出版社, 2003.
[12] 杨郁, 张建生. 船舰尾流前向散射的缪勒矩阵特性研究[J]. 光学学报, 2011, 31(11): 1101006.
[13] van de Hulst H C. Light scattering by small particles[M]. New York: John Wiley & Sons Incorporation, 1957: 201- 208.
[15] 卜敏, 王亚伟, 金卫凤, 等. 单核细胞散射光强调制在细胞形态研究中的作用[J]. 中国激光, 2011, 38(11): 1104001.
[17] 吴金雷, 张金碧, 张莉, 等. 大气颗粒物近前向光散射特性研究[J]. 光学学报, 2016, 36(5): 0529001.
[18] 汪加洁, 韩一平, 韩璐, 等. 单核细胞对高斯激光波束散射特性理论分析[J]. 光散射学报, 2014, 26(1): 8-12.
Article Outline
卜敏, 胡双双, 陶兆禾, 金卫凤, 王亚伟. 白细胞对偏振光的散射特性及散射特性与细胞结构的关系[J]. 中国激光, 2017, 44(10): 1007001. Bu Min, Hu Shuangshuang, Tao Zhaohe, Jin Weifeng, Wang Yawei. Scattering Characteristics of Leukocytes on Polarized Light and Relationship Between Scattering Characteristics and Cell Structure[J]. Chinese Journal of Lasers, 2017, 44(10): 1007001.







