光纤荧光探针  下载: 2381次
下载: 2381次
1 引言
荧光光谱分析具有灵敏度高、选择性强、试样所需用量少、方法简便等众多优点[1]。但传统的光谱传感仪器大多由分立的光学元件组建,需要在较为稳定的环境下运行,体积大,价格昂贵,对使用环境也存在限制。随着光谱应用领域的不断拓展,光谱传感仪器的小型化和便携化是不可避免的发展趋势。20 世纪 70 年代,光纤的出现使得光谱传感仪器的发展有了新的突破口。光纤体积小、质量小,将其用在光谱传感仪器中承载光波,能够极大地简化传统光学元件构建的光路,使光谱分析系统朝着小型化、集成化的方向发展。光纤损耗小、稳定性高,能够适应危险和恶劣的环境,用在传感器中可实现远端探测、实时分析、现场检测和动态监测等[2-3]。因此光纤光谱传感器具有重要的研究意义和实用价值。
本文简要总结了荧光作用原理和光纤探针空间光传导理论,综述了包括多光纤合束、单根光纤、单像素、多像素、双包层光纤、光子晶体光纤,以及锥形光纤探针在内的多种不同结构的光纤荧光探针及制备方法。归纳了光纤荧光探针 的应用,对其进一步发展进行了展望。
2 荧光分析原理
物质的分子或原子吸收电磁辐射(通常为紫外光或波长较短的可见光)后,先由基态跃迁到激发态,并且立即退激发,辐射出比激发波长更长的光。当激发光消失时,辐射过程也立即停止,这种辐射出的光即为荧光。此外,物质的荧光光谱与激发光源的波长无关,只与物质本身成分和其能级结构相关。因而人们可以根据物质的激发光谱[4]、发射光谱[5]、荧光强度[6-7]、量子产率[8-9]、荧光寿命[10]、荧光偏振[11-12]等参数来定性或定量地检测分析物质的成分信息。
理论上任何物质分子都有吸收光谱,但不是所有的物质都会产生荧光。分子产生荧光需具备以下两个条件:1)具有较强的紫外-可见吸收;2)具有一定的荧光量子产率。这也就决定了并不是所有的物质分子都可以进行荧光测量。通常当被测分子有荧光效应且荧光效率较高时可直接测量;当其荧光效率较低时,可通过荧光猝灭法测定荧光熄灭剂的浓度[13-14];当其无荧光效应时,可通过荧光染料标记,将其转变为适合测定的荧光物质。后两种方法能够间接地反映被测物的信息。常见的荧光染料有荧光素和罗丹明类[15],BODIPY类[16]。甄文等[17]较为全面地介绍了各类荧光染料,并详细地介绍了BODIPY类染料的作用原理与发展状况。
荧光分析具有很多优点:灵敏度高、选择性强、试样所需用量少、方法简便等。荧光分析法与激光和光纤技术的结合,推动了光纤荧光探针的诞生和发展,极大地扩展了其应用范围。
3 光纤探针空间传导理论
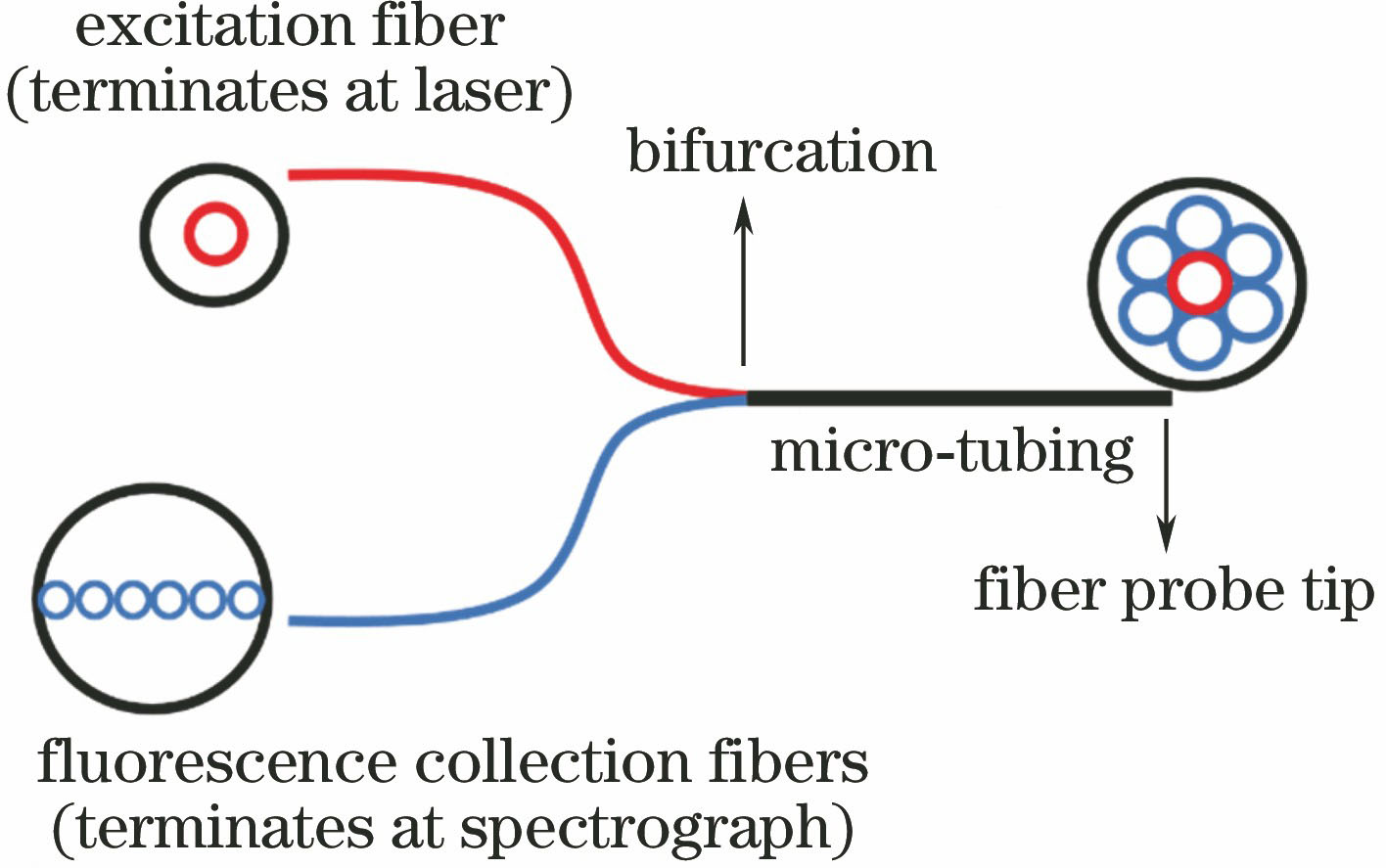
光纤探针是一种利用光纤尺寸小、灵活自由、损耗低、易加工的特点制作的能够传导泵浦光、接收并传导信号光的器件,具有灵活多变的结构,能够与光电检测设备连接进行信号分析。
1984年Schwab等[18]和1986年Plaza等[19]在光纤探针空间光传输理论方面做了开创性工作。1988年,Hendra等[20]将发射光纤和收集光纤同时与被测样品保持垂直,获得了最大的激发效率和接收效率。1996年,夏威夷大学的Cooney等[21]将Schwab等[18-19]的理论进行了拓展,严格分析了发光点对应的立体角和不同接收区的限制因素,同时在理论模拟中考虑了光纤端面实际的激光强度分布函数。目前,已经有许多关于这一主题的研究论文,Cooney等[21]和Bünting等[22]的理论模型最为全面严谨。

图 2. 等径双光纤平头探针结构
Fig. 2. Flat-head probe structure consisting of two fibers with identical diameters
Ma等[23]提出了一种简单直接的方法并进行理论模拟。等径双光纤平头探针(
如
式中:r为纤芯内径;R为h高处的光锥截面直径。将(1)式变形得
在不同高度h处,激光功率密度不同,但总光强相同。令泵浦光在h高处的功率密度为Pe(h),在光出射端面功率密度为Pe(0),则信号光的光强可表示为
因此有
荧光强度If(h)不仅和泵浦光强度有关,还与被测体积、被测溶液的浓度c、被测物的光子产率Q,以及摩尔吸收系数ε有关,表达式为
式中:系数k为常数,可通过校准求出其值。从H0到H的重叠部分中,有效收集的荧光总强度If为
式中:H0=t/tanθ0,t为光纤包层厚度,特定光纤的H0为一定值。
将(2)式和(4)式代入(6)式中,得到
令γ=2·k·Q·ε·c·Pe(0)·r2,代入(7)式变形可得
且已知R=r+htanθ0,将其代入(8)式中可得
式中:α=tanθ0/r为常数;H0=t/tanθ0。
由(9)式可知,当被测溶液的参数一定时,纤芯直径r和包层厚度t影响荧光收集强度,且r的影响力极大;当包层厚度t减小时,积分下限H0减小,可通过减小重叠死角来增大If,但是当检测深度H足够大时,t的影响可以忽略不计;数值孔径NA对If的影响也尤为显著,由NA=nsinθ0可知,当纤芯的折射率n一定时,随着NA的增大,sinθ0增大,即H0的减小和α的增大都可促使If增大;检测深度H的增加有利于荧光的收集,其值与容器和光传输距离有关,可通过实验测量。
光纤探针的空间传导模型往往建立在射线光学的基础上,原因在于,对于泵浦光与信号光的波长而言,光纤探针端面的尺寸足够大。该理论模型假设探针端面的光是均匀分布的,样品为无吸收稀释样品,泵浦光在传输过程中没有损耗,这在一定程度上简化了模型,但是将其应用于强吸收或浑浊样品时偏差较大,因此在实际应用中需要考虑泵浦光实际光强分布,以及由被测样品所导致的光强衰减。
4 光纤荧光探针的结构与制作工艺
4.1 单像素光纤束荧光探针
随着光纤技术的发展,通过改善光纤探针的结构来提高荧光收集效率是常用手段之一。用于测量荧光光谱的典型光纤探针由两根或两根以上的平头光纤组成,其中的发射光纤和收集光纤相互独立,从而能够避免发射光纤中产生的背景信号发生干扰。光纤荧光探针由发射光纤、收集光纤、填充物和套管组成,其中由7根等径光纤组成的探针结构较为经典,如

图 3. 7根等径光纤组成的探针结构。(a)结构模型图;(b)探针实物显微图
Fig. 3. Flat-head probe structure consisting of seven fibers with identical diameters. (a) Structural model; (b) micrograph of probe

图 4. 光纤探针结构和荧光光谱系统
Fig. 4. Structure of optical-fiber probe and fluorescence spectroscopy system
4.2 多像素光纤束荧光探针
以上所述光纤探针结构都能进行单像素点检测,获得小体积组织的光谱信息。然而,在许多生物医学应用中,必须对组织表面进行研究,以确定病变的范围或潜在损伤的位置。如
4.3 双包层单光纤荧光探针
由多根光纤组成的光纤荧光探针难以避免地会导致探针体积变大,难以适用于狭窄管道的检测或微创手术检测。Wang等[28]构建了一种基于双包层单根光纤探针和专用耦合器的荧光光谱系统,其原理如
![多像素光纤探针结构图。(a)端面结构模型图;(b)实物探针显微图[27]](/richHtml/lop/2020/57/1/010003/img_5.jpg)
图 5. 多像素光纤探针结构图。(a)端面结构模型图;(b)实物探针显微图[27]
Fig. 5. Structure of multipixel opitcal-fiber probe. (a) Model diagram of end-face structure; (b) micrograph of probe[27]

图 6. 基于单根双包层光纤探针的荧光光谱系统
Fig. 6. Fluorescence spectroscopy system based on single double-clad optical-fiber probe
4.4 光子晶体光纤荧光探针
光子晶体光纤因其结构的灵活性和模式传输的独特性,突破了传统光纤的限制,被应用于化学和生物传感领域。Myaing等[29]设计了一种新的双包层光子晶体光纤(如
![大模场双包层光子晶体光纤的扫描电镜图[29]](/richHtml/lop/2020/57/1/010003/img_7.jpg)
图 7. 大模场双包层光子晶体光纤的扫描电镜图[29]
Fig. 7. Scanning electron micrographs of large-mode-field double-clad photonic crystal fiber[29]
光子晶体光纤不仅可以作为光通道,也能作为流体通道,可以容纳在纤芯附近甚至芯内以气态或液态形式存在的生物化学样品,使样品和光的重叠度高,通过限制光波的传输,从而提高荧光收集效率,因此光子晶体光纤常被用于液体荧光的检测。由于空气纤芯尺寸极小,在实用光学测量技术中,被测物体积一般只需1~10 mL即可,这在化学和生物医学应用中意义重大,如分析物检测、蛋白质或DNA识别[30]。但是光子晶体光纤荧光探针也存在一些问题:当分布于微通道内的样品注入、排放不完全时,微通道内会产生间隙,使得样品不连续;光子晶体光纤在测量期间需要频繁更换,而通道内液相转移缓慢,无法满足在线监测仪器的高通量要求,导致重复性差。
光子晶体光纤的制备方法主要有堆积法、挤压法、酸腐蚀法、填充法、叠片法和发泡法等。宋明丽等[31-32]详细讲述了光子晶体光纤的特性及制备方法。虽然目前光子晶体光纤在光纤荧光探针上的应用仍不多,但相关研究已经取得了一定的进展,为商业应用开启了新的道路。
4.5 锥形光纤荧光探针
锥形光纤探针中较为典型的结构为椎柱组合型,锥柱组合型的光纤探针中倏逝波渗透深度较大且泄露波少,最有利于倏逝波传感[33]。锥形光纤的制备方法主要包括熔融拉锥法、溶液腐蚀法和熔拉-腐蚀法等[34-35]。其中,管腐蚀法是椎柱组合型探针最常用的制备方法,如

图 8. 利用管腐蚀法制备锥柱型光纤荧光探针
Fig. 8. Preparation of cone-column optical-fiber fluorescent probe by using tube etching
锥形光纤探针常用于倏逝波传感,传感原理与上述理论不同,由于被测介质折射率通常小于光纤折射率,光纤内的激发光在界面处发生全反射,同时形成具有一定传感范围的倏逝场。利用锥形光纤探针进行传感时,在探针的裸纤表面附着识别分子(抗体),将探头置于已用荧光染料标记的待测生物分子(抗原)溶液中,抗体与抗原结合后,荧光染料被倏逝波激发产生荧光,通过探针收集荧光实现传感,其原理如

图 9. 锥柱形光纤探针用于倏逝波传感的原理图
Fig. 9. Principle of cone-column optical-fiber probe for evanescent-wave sensing
5 光纤荧光探针的应用
早在20世纪60年代,就有科学家提出了利用光纤制作探针来输出和收集样品光信号的构思,并设计了光纤探针结构[38-39]。随着光纤荧光探针的发展,光纤荧光探针在生命科学、工业、农业、环境科学、材料科学、食品科学等领域均有应用,其中在生物医学研究领域的应用尤为突出。
5.1 生物医学研究
1980年,Peterson等[40-41]将光纤作为探针,发明了一种柔性结构的植入式pH测量装置,成功实现了对肌肉或其他组织中pH变化的检测,开辟了光纤荧光探针在生物传感方面应用的先河。在20世纪80年代,利用光纤荧光探针实现了对体内青霉素[42]、氧浓度、CO2浓度[43]、葡萄糖浓度[44]等的检测。
随后,含有光纤探针的荧光内窥镜系统也开始蓬勃发展。将波长较短的紫光照射到组织上,能够激发细胞产生自体荧光,依据人体组织固有荧光光谱特征可自动鉴别被测组织是否发生恶性病变,其检测灵敏度高,特异性强,可提高早期癌和异型增生的诊断率。1990年,Cothren等[45]开发了内窥镜兼容的光纤系统,用于在内窥镜检查期间获得黏膜被激光诱导所产生的实时荧光光谱,该系统能准确区分腺瘤、正常结肠黏膜及增生性息肉,灵敏度极高。21世纪初,随着临床经验的积累和内镜技术的进步,荧光内窥镜的应用已扩展到人体内各个部位。Myaing等[46]研制了一种用于双光子荧光成像的微型、柔性光纤扫描内窥镜,该内窥镜采用双包层光纤传输激发光和收集双光子荧光,实现了对荧光珠和癌细胞的实时成像,光纤剖面和系统原理如
![双光子荧光成像的光纤扫描内窥镜。(a)双包层光纤探针横截面图;(b)光纤扫描双光子荧光内窥镜成像系统原理图[46]](/richHtml/lop/2020/57/1/010003/img_10.jpg)
图 10. 双光子荧光成像的光纤扫描内窥镜。(a)双包层光纤探针横截面图;(b)光纤扫描双光子荧光内窥镜成像系统原理图[46]
Fig. 10. Fiber-optic scanning two-photon fluorescence endoscope. (a) Cross-section of double-clad optical-fiber probe; (b) principle of optical-fiber scanning two-photon fluorescence endoscope imaging system[46]
光纤探针具有可长期将纤维植入脑组织的潜力,使其在神经科学研究工作中备受关注[50]。光纤探针在神经细胞研究系统中有三个技术要点[51]:1)通过光纤探针有效地向样品传输光子的同时将激发光的功率降到最低;2)在尽可能大和深的区域内以较高时空分辨率有效地收集荧光;3)保持良好的信噪比。2017年,Fedotov等[52]证明一束可寻址的光纤能够从转基因小鼠活体大脑或取出的完整大脑的单个神经元中,实现三维光学读出。由于光纤束中的单根光纤直径只有几微米,因此从光纤束传输的大脑图像中分辨出单个神经元并不困难。另外,Pochechuev等[53]通过研究转基因小鼠活体大脑中的单个可寻址神经元与特定结构的光纤探针之间的光学耦合效应,证明了能够利用双光子成像技术实现对单个神经元的定位,并利用光纤探针对双光子成像精确定位的单个锥体神经元进行了光纤讯问以及定量原位分析(
![通过光纤探针对Thy1-EGFP小鼠大脑内神经元群进行扫描,获得的双光子荧光图像,能够定量评估激光扫描对神经元造成的机械效应[53]。(a)~(c) 光纤探针(红色)扫描时单个神经元的位移场(其位置变化由圆圈1~4标记);(d)正常神经元的近景;(e)扭曲神经元的近景](/richHtml/lop/2020/57/1/010003/img_11.jpg)
图 11. 通过光纤探针对Thy1-EGFP小鼠大脑内神经元群进行扫描,获得的双光子荧光图像,能够定量评估激光扫描对神经元造成的机械效应[53]。(a)~(c) 光纤探针(红色)扫描时单个神经元的位移场(其位置变化由圆圈1~4标记);(d)正常神经元的近景;(e)扭曲神经元的近景
Fig. 11. Two-photon fluorescence images obtained by scanning groups of neurons inside brain of Thy1-EGFP mouse by optical-fiber probe can enable a quantitative assessment of mechanical effects caused by laser scanning on neurons[53]. (a)-(c) Field of displacements of individual neurons (whose changing positions are labeled by circles 1-4) scanned by optical-fiber probe (red); (d) close-up view of normal neurons; (e) close-up view of distorted neurons
![急性诊断和慢性诊断对比图[54]。(a)急性诊断;(b)慢性诊断](/richHtml/lop/2020/57/1/010003/img_12.jpg)
图 12. 急性诊断和慢性诊断对比图[54]。(a)急性诊断;(b)慢性诊断
Fig. 12. Comparison between acute and chronic diagnosis[54]. (a) Schematic of acute diagnosis; (b) schematic of chronic diagnosis
5.2 环境及水质检测
环境污染物,包括工农业副产品、天然毒素等水中各种有害物质,可直接或间接地影响动物和人体的健康。通过地下水和土壤监测、河流取样或气溶胶微粒测试等环境监测,可以对危险条件或污染事件进行早期预警。早在1975年,Lübbers等[55]制造出第一个用于环境检测的光纤荧光传感器,利用渗透膜将荧光染料芘丁酸或羟甲香豆素固定在光纤端面,分别检测气体或液体中的PO2或PCO2,通过光纤传输将光传输至光纤端面以激发荧光染料产生荧光信号来实现传感。如今,各行业的发展无不强调环境保护的重要性,光纤荧光传感逐渐发展成为环境及水质监测的重要手段,用于土壤农药[56-57],水质重金属离子、pH、溶解氧、浊度[58-59],以及大气环境中氨气(NH3)、二氧化氮(NO2)、甲烷(CH4)、乙炔(C2H2)等物质的检测[60]。例如,
![用于土壤中农药检测的光纤荧光测量系统[56]。(a)检测系统总体方案;(b)锥形钻进器](/richHtml/lop/2020/57/1/010003/img_13.jpg)
图 13. 用于土壤中农药检测的光纤荧光测量系统[56]。(a)检测系统总体方案;(b)锥形钻进器
Fig. 13. Optical-fiber-probe-based fluorescence measurement system for pesticide detection in soil[56]. (a) Overview of measurement system; (b) taper-shaped aiguille
5.3 食品安全检测
食品安全是人们普遍关注的问题。细菌、病毒、寄生虫病原体和毒素是与食品相关的导致人类发病和死亡的重要源头;食品中存在的过敏原、杀虫剂和抗菌化合物也会对人类身体造成不同程度的损害。食品安全检测内容包括:食品农药残留、兽药、食品添加剂、生物毒素、治病菌和抗生素等[60]。如今食品的快速检测主要依赖于检测试纸。但目前国内的试纸种类十分有限,性能指标还远达不到检测要求[61],食品安全检测仍然以色谱法和色质联用法为主,然而该方法所用的仪器价格昂贵,需专人操作,不利于快速检测[62]。生物荧光传感技术具备灵明度高、选择性好、分析速度快等特点,能够对食品进行快速检测。将光纤探针与生物荧光传感结合,不仅能实现对食品的快速检测,也能实现原位、过程化检测,达到控制生产和保证质量的目的,因此光纤荧光探针技术在食品检测方面有着广泛的应用前景。
5.4 其他应用
光纤荧光探针还能够用于**安全、药物安全与执法等领域,这些领域与上述应用多有重叠交叉的部分,在此不赘述。目前,材料的基础研究常用的大型空间光谱仪器,多依赖于进口,且价格昂贵、维护成本高。本团队致力于开发基于光纤的荧光光谱测试系统,并将其用于材料科学基础研究领域。前期本课题组已搭建了可移动三维光纤荧光测试平台,制备出六合一的光纤探针,并且利用该探针检测了稀土掺Yb3+光纤预制棒切片中稀土离子的空间分布情况。此外,本课题组将光纤荧光探针用于发光材料制备过程中,实时监控离子发光的状态,这对材料制备过程与反应机理的研究具有重大意义。
6 结束语
对于激发光和荧光,光纤荧光探针均利用光纤来进行传输,可以替代传统的空间光路,实现荧光光谱仪的集成化、小型化和免维护,是光纤和光纤器件的一个创新性应用。本文简要叙述了荧光作用原理、光纤探针尖端的激光发射与荧光收集的空间传导理论、光纤荧光探针典型结构及其应用。虽然光纤荧光探针的应用遍及多个领域,但仍有一些尚未解决的难题:1)荧光收集效率还需进一步提高,以满足弱荧光检测需求;2)信噪比难以提升到理想状态;3)探针结构尺寸难以达到光波长级别,以探测和分辨微纳材料和结构发光;4)在光纤原位荧光探测方面也需要进一步发展。解决这些困难的关键在于设计出性能优异且与其应用环境相匹配的探针结构,因此探针结构的设计和性能改善仍是未来重要的研究方向。先进的光子学技术、纳米光子学、超材料、集成光学、流体元件以及手工制造技术的发展将为光纤荧光探针的发展提供新的机遇。未来以光纤为基础的荧光分析系统将向高效率、高精度、高集成度、原位探测、低成本的方向发展。
[1] Carstea E M, Bridgeman J, Baker A, et al. Fluorescence spectroscopy for wastewater monitoring: a review[J]. Water Research, 2016, 95: 205-219.
[2] Bachmann L. Zezell D M, da Costa Ribeiro A, et al. Fluorescence spectroscopy of biological tissues: a review[J]. Applied Spectroscopy Reviews, 2006, 41(6): 575-590.
[3] Cooney T F, Skinner H T, Angel S M. Comparative study of some fiber-optic remote Raman probe designs. Part I: model for liquids and transparent solids[J]. Applied Spectroscopy, 1996, 50(7): 836-848.
[4] 卢璐, 苏荣国, 胡序朋, 等. 高斯分解法研究浮游植物荧光激发光谱[J]. 中国激光, 2007, 34(8): 1115-1119.
[5] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710.
[6] Leavesley S J, Deal J, Hill S, et al. Colorectal cancer detection by hyperspectral imaging using fluorescence excitation scanning[J]. Proceedings of SPIE, 2018, 10489: 104890K.
[7] Li D, Jing P T, Sun L H, et al. Near-infrared excitation/emission and multiphoton-induced fluorescence of carbon dots[J]. Advanced Materials, 2018, 30(13): 1705913.
[8] Fennel F, Gershberg J, Stolte M, et al. Fluorescence quantum yields of dye aggregates: a showcase example based on self-assembled perylene bisimide dimers[J]. Physical Chemistry Chemical Physics, 2018, 20(11): 7612-7620.
[9] Naaz S, Poddar S, Bayen S P, et al. Tenfold enhancement of fluorescence quantum yield of water soluble silver nanoclusters for nano-molar level glucose sensing and precise determination of blood glucose level[J]. Sensors and Actuators B: Chemical, 2018, 255: 332-340.
[10] Kalytchuk S, Wang Y. Pola'kova' K, et al. Carbon dot fluorescence-lifetime-encoded anti-counterfeiting[J]. ACS Applied Materials & Interfaces, 2018, 10(35): 29902-29908.
[11] Zhao Q, Tao J, Uppal J S, et al. Nucleic acid aptamers improving fluorescence anisotropy and fluorescence polarization assays for small molecules[J]. TrAC Trends in Analytical Chemistry, 2019, 110(12): 401-409.
[12] Glahn-Martínez B, Benito-Peña E, Salis F, et al. Sensitive rapid fluorescence polarization immunoassay for free mycophenolic acid determination in human serum and plasma[J]. Analytical Chemistry, 2018, 90(8): 5459-5465.
[13] Wang R Z, Yang S K, Fang J, et al. Characterizing the interaction between antibiotics and humic acid by fluorescence quenching method[J]. International Journal of Environmental Research and Public Health, 2018, 15(7): 1458.
[14] Yang H, Ran G H, Yan J J, et al. A sensitive fluorescence quenching method for the detection of tartrazine with acriflavine in soft drinks[J]. Luminescence, 2018, 33(2): 349-355.
[15] Kubin R F, Fletcher A N. Fluorescence quantum yields of some rhodamine dyes[J]. Journal of Luminescence, 1982, 27(4): 455-462.
[16] Turksoy A, Yildiz D, Akkaya E U. Photosensitization and controlled photosensitization with BODIPY dyes[J]. Coordination Chemistry Reviews, 2019, 379: 47-64.
[17] 甄文, 王南翔, 祁欣. 荧光染料的简介及BODIPY类的发展历程[J]. 有机化学研究, 2017, 5(1): 21-33.
Zhen W, Wang N X, Qi X. Introduction to fluorescent dyes and development of BODIPY classes[J]. Journal of Organic Chemistry Research, 2017, 5(1): 21-33.
[18] Schwab S D. McCreery R L. Versatile, efficient Raman sampling with fiber optics[J]. Analytical Chemistry, 1984, 56(12): 2199-2204.
[19] Plaza P, Dao N Q, Jouan M, et al. Simulation et optimisation des capteurs à fibres optiques adjacentes[J]. Applied Optics, 1986, 25(19): 3448-3454.
[20] Hendra P J, Ellis G, Cutler D J. Use of optical fibres in Raman spectroscopy[J]. Journal of Raman Spectroscopy, 1988, 19(6): 413-418.
[21] Cooney T F, Skinner H T, Angel S M. Comparative study of some fiber-optic remote Raman probe designs. Part II: tests of single-fiber, lensed, and flat- and bevel-tip multi-fiber probes[J]. Applied Spectroscopy, 1996, 50(7): 849-860.
[22] Bünting U, Lewitzka F, Karlitschek P. Mathematical model of a laser-induced fluorescence fiber-optic sensor head for trace detection of pollutants in soil[J]. Applied Spectroscopy, 1999, 53(1): 49-56.
[24] Utzinger U. Richards-Kortum R R. Fiber optic probes for biomedical optical spectroscopy[J]. Journal of Biomedical Optics, 2003, 8(1): 121-148.
[25] Pera V, Tan X F, Runnels J, et al. Diffuse fluorescence fiber probe for in vivo detection of circulating cells[J]. Journal of Biomedical Optics, 2017, 22(3): 037004.
[26] Pitris CD. Flourescence imaging instrumentation and clinical study for the diagnosis of cervical pre-cancer and cancer[D]. Austin: University of Texas at Austin, 1995: 13- 19.
[27] AgrawalA. Multi-pixel fluorescence spectroscopy for the diagnosis of cervical precancer[D]. Austin: University of Texas at Austin, 1998: 15- 20.
[28] Wang L, Choi H Y, Jung Y, et al. Optical probe based on double-clad optical fiber for fluorescence spectroscopy[J]. Optics Express, 2007, 15(26): 17681-17689.
[29] Myaing M T, Ye J Y, Norris T B, et al. Enhanced two-photon biosensing with double-clad photonic crystal fibers[J]. Optics Letters, 2003, 28(14): 1224-1226.
[31] 宋明丽, 王小平, 王丽军, 等. 光子晶体制备及其应用研究进展[J]. 材料导报, 2016, 30(7): 22-27.
Song M L, Wang X P, Wang L J, et al. Advances in the fabrication and application of photonic crystals[J]. Materials Review, 2016, 30(7): 22-27.
[32] 王伟, 侯蓝田. 光子晶体光纤的现状和发展[J]. 激光与光电子学进展, 2008, 45(2): 43-58.
[33] 刘婷. 基于荧光与表面增强拉曼光谱的光纤生化传感器[D]. 北京: 清华大学, 2014: 20- 35.
LiuT. Optical fiber biochemical sensor based on fluorescence and surface enhanced Raman spectra[D]. Beijing: Tsinghua University, 2014: 20- 35.
[34] 王少辉, 严英占, 姜国庆, 等. 锥型光纤的制备和理论分析[J]. 纳米科技, 2009, 6(1): 11-13, 57.
Wang S H, Yan Y Z, Jiang G Q, et al. Fabrication and analyze of the taper-fiber[J]. Nanoscience & Nanotechnology, 2009, 6(1): 11-13, 57.
[35] 王慧, 任宏亮, 何金田, 等. 管腐蚀法制作纳米光纤探针[J]. 激光技术, 2004, 28(4): 417-419.
[36] Zhu X Y, Wang R Y, Xia K D, et al. Nucleic acid functionalized fiber optic probes for sensing in evanescent wave: optimization and application[J]. RSC Advances, 2019, 9(4): 2316-2324.
[37] Taitt C R, Anderson G P, Ligler F S. Evanescent wave fluorescence biosensors: advances of the last decade[J]. Biosensors and Bioelectronics, 2016, 76: 103-112.
[38] Kissinger C D. Fiber optic proximity probe: US3327584[P/OL].1967-06-27[2019-04-25]. https:∥patents.glgoo.top/patent/US3327584A/en.
[39] Hicks JW, Jr, Polanyi M L. Flexible optical probe: US3068739[P/OL].1962-12-18[2019-04-25]. https:∥patents.glgoo.top/patent/US3068739A/en.
[40] Peterson J I, Goldstein S R, Fitzgerald R V, et al. Fiber optic pH probe for physiological use[J]. Analytical Chemistry, 1980, 52(6): 864-869.
[41] Peterson JI, Goldstein S R. Fiber optic pH probe: US4200110[P].1980-04-29[2019-04-26]. https:∥patents.glgoo.top/patent/US4200110A/en.
[42] Kulp T J, Camins I, Angel S M, et al. Polymer immobilized enzyme optrodes for the detection of penicillin[J]. Analytical Chemistry, 1987, 59(24): 2849-2853.
[43] Peterson J I, Fitzgerald R V, Buckhold D K. Fiber-optic probe for in vivo measurement of oxygen partial pressure[J]. Analytical Chemistry, 1984, 56(1): 62-67.
[44] Peterson J, Vurek G. Fiber-optic sensors for biomedical applications[J]. Science, 1984, 224(4645): 123-127.
[45] Cothren R M, Richards-Kortum R, Sivak M V. Jr, et al. Gastrointestinal tissue diagnosis by laser-induced fluorescence spectroscopy at endoscopy[J]. Gastrointestinal Endoscopy, 1990, 36(2): 105-111.
[46] Myaing M T. MacDonald D J, Li X D. Fiber-optic scanning two-photon fluorescence endoscope[J]. Optics Letters, 2006, 31(8): 1076-1078.
[47] Riedl C R, Daniltchenko D, Koenig F, et al. Fluorescence endoscopy with 5-aminolevulinic acid reduces early recurrence rate in superficial bladder cancer[J]. Journal of Urology, 2001, 165(4): 1121-1123.
[48] Stepp H, Sroka R, Baumgartner R. Fluorescence endoscopy of gastrointestinal diseases: basic principles, techniques, and clinical experience[J]. Endoscopy, 1998, 30(4): 379-386.
[49] Asanuma D, Sakabe M, Kamiya M, et al. Sensitive β-galactosidase-targeting fluorescence probe for visualizing small peritoneal metastatic tumours in vivo[J]. Nature Communications, 2015, 6: 6463.
[50] Sych Y, Chernysheva M, Sumanovski L T, et al. High-density multi-fiber photometry for studying large-scale brain circuit dynamics[J]. Nature Methods, 2019, 16(6): 553-560.
[51] Yang W J, Yuste R. In vivo imaging of neural activity[J]. Nature Methods, 2017, 14(4): 349-359.
[52] Fedotov I V, Pochechuev M S, Ivashkina O I, et al. Three-dimensional fiber-optic readout of single-neuron-resolved fluorescence in living brain of transgenic mice[J]. Journal of Biophotonics, 2017, 10(6/7): 775-779.
[53] Pochechuev M S, Fedotov I V, Ivashkina O I, et al. Two-photon imaging of fiber-coupled neurons[J]. Journal of Biophotonics, 2018, 11(1): e201600203.
[54] Schlegel F, Sych Y, Schroeter A, et al. Fiber-optic implant for simultaneous fluorescence-based calcium recordings and BOLD fMRI in mice[J]. Nature Protocols, 2018, 13(5): 840-855.
[55] Lübbers D W, Opitz N. The pCO2-/pO2-optode: a new probe for measurement of PCO2 or PO2 in fluids and gases (authors transl)[J]. Zeitschrift fur Naturforschung. Section C, Biosciences, 1975, 30(4): 532-533.
[56] 王忠东, 闫铁, 王宝辉. 适于土壤中农药检测的荧光光纤系统[J]. 光学精密工程, 2008, 16(7): 1208-1212.
[57] Andreou V G, Clonis Y D. A portable fiber-optic pesticide biosensor based on immobilized cholinesterase and sol-gel entrapped bromcresol purple for in-field use[J]. Biosensors and Bioelectronics, 2002, 17(1/2): 61-69.
[58] 陈浩, 刘月明, 邹建宇, 等. 光纤水质检测技术的研究现状与发展趋势[J]. 激光与光电子学进展, 2015, 52(3): 030006.
[59] Yeh P, Yeh N, Lee C H, et al. Applications of LEDs in optical sensors and chemical sensing device for detection of biochemicals, heavy metals, and environmental nutrients[J]. Renewable and Sustainable Energy Reviews, 2017, 75: 461-468.
[60] Taitt C R, Anderson G P, Ligler F S. Evanescent wave fluorescence biosensors: advances of the last decade[J]. Biosensors and Bioelectronics, 2016, 76: 103-112.
[61] 谢刚, 叶金, 王松雪. 食品安全快速检测方法评价技术研究进展[J]. 食品科学, 2016, 37(17): 270-274.
Xie G, Ye J, Wang S X. Progress in the validation of rapid food safety detection methods[J]. Food Science, 2016, 37(17): 270-274.
[62] 王洪涛, 张晓东, 周刚. 新形势下食品安全检验检测技术应用研究[J]. 现代食品, 2018( 16): 100- 101.
Wang HT, Zhang XD, ZhouG. Study on application of food safety inspection technology under new situation[J]. Modern Food, 2018( 16): 100- 101.
Article Outline
周艳焰, 肖永川, 孙力军, 陈阳, 廖世彪, 邱强, 辜之木, 戴能利, 李进延. 光纤荧光探针[J]. 激光与光电子学进展, 2020, 57(1): 010003. Yanyan Zhou, Yongchuan Xiao, Lijun Sun, Yang Chen, Shibiao Liao, Qiang Qiu, Zhimu Gu, Nengli Dai, Jinyan Li. Optical-Fiber Fluorescent Probes[J]. Laser & Optoelectronics Progress, 2020, 57(1): 010003.