β-淀粉样蛋白斑块的无标记成像及光动力降解  下载: 1252次
下载: 1252次
1 引言
阿尔兹海默症(AD)是一种典型的中枢神经系统退行性疾病,在我国现有约1000万痴呆患者中,AD占全部患者总数的50%~70%,其在全世界范围内的患病率也在逐渐增加[1]。在晚期AD患者的脑部中可以检测到大量的以β-淀粉样蛋白(Aβ)沉积为核心的神经炎型斑块状聚集体及神经纤维缠结。目前对AD发病机制的解释仍在探索中,但大多数研究主要支持淀粉样蛋白级联假设(ACH),即认为沉积的斑块会引起神经细胞的损伤和死亡,最终导致痴呆[2]。研究表明,在AD患者中,淀粉样蛋白前体(APP)会过度表达,随后通过先后切割β分泌酶和γ分泌酶,再进一步自发聚集形成低聚物或淀粉样纤维及聚集斑块,从而产生神经毒性作用。因此,有效地检测并抑制Aβ聚集体的形成或对其进行降解有可能达到预防或治疗AD的效果[3]。除了传统的免疫荧光标记之外,目前已有较多研究利用Aβ斑块的光学性质对其进行无标记成像,如利用多光子成像可以在近红外波段对Aβ斑块实现活体的无标记成像[4],复旦大学季敏标教授课题组[5]通过研究Aβ斑块的非线性光学性质,利用受激拉曼散射对斑块实现了无标记成像。
光动力治疗(PDT)是一种联合光、光敏剂和组织中的氧分子,通过光动力学反应选择性地破坏病变组织的全新治疗技术[6]。光敏剂只有在特定波长的光照下才会被激发并与周围物质反应产生活性氧(ROS),达到使细胞凋亡及组织坏死等作用,故其具有良好的安全性、选择性和微创性,被广泛地应用于眼底黄褐斑病变、鲜红斑痣、恶性肿瘤等疾病中,具有广阔的医疗前景[7-8]。目前应用较多的光敏剂主要是单体化合物,大多为四吡咯类化合物的衍生物,包括卟啉、卟吩、二氢卟吩、内源性卟啉前体等,其他还有金属酞菁、稠环醌类化合物等。为了提高对病灶的选择性,并提高其在体内的传递效率,通常在光敏剂原有基础上进行修饰和纳米包载,如糖偶联光敏剂、脂质体包载光敏剂等[9]。光敏剂被激发产生的ROS也能破坏碳骨架,使得蛋白质被降解,因此近年来PDT也被应用于Aβ斑块的降解中,并已通过原子力显微镜、电泳、圆二色性分析等方法证实[10-11]。除此之外,研究人员对多种光敏剂进行修饰并将其与纳米粒子相结合,使之具有较高的选择性、特异性和生物相容性,这在Aβ抑制剂的研究中有重要意义[12]。
在本研究中,利用化学名为苯并卟啉衍生物一元酸环-A(BPD)的光敏剂维替泊芬实现对体外Aβ斑块的光动力降解,并通过酶联免疫吸附测定(ELISA)定量检测降解效率。由于Aβ斑块具有明显的自体荧光,利用双光子和谐波等非线性光学成像方法对其降解过程进行实时成像记录,同时探讨了不同BPD浓度对斑块的降解效率,并利用ELISA检测方法进行了定量分析。为了更好地应用到活体中,将BPD包载于脂质体中,为未来实现在体的低细胞毒性Aβ斑块降解和实时检测提供了新的途径。
2 方 法
2.1 Aβ斑块的制备
称取1 mg的Aβ1-42冻干粉溶于200 μL预冷的六氟异丙醇(HFIP)中,密封并涡旋混匀后,室温下静置60 min,直到液体澄清,得到Aβ-HFIP溶液。取4支无菌的1.5 mL的EP管,每支分装50 μL 的Aβ-HFIP溶液,使用真空冷冻干燥仪挥干HFIP,得到无色透明的Aβ肽膜,并将其置于-20 ℃冰箱保存。每次临用前,取一支分装管,向肽膜内加入10 μL的二甲基亚砜(DMSO),水浴超声(功率为300 W,频率为 35 Hz)处理10 min,得到Aβ-DMSO溶液;向Aβ-DMSO溶液中加入预冷的440 μL的磷酸盐缓冲液(PBS),得到0.5 mg/mL的Aβ溶液;将得到的溶液置于4 ℃冰箱内孵育1 d,使用高速冷冻离心机于4 ℃温度、13000 r/min的离心速度离心10 min以去除杂质;最后将得到的溶液置于37 ℃环境下孵育2周,取样滴于共焦皿中进行实验。
2.2 BPD溶液和脂质体的制备
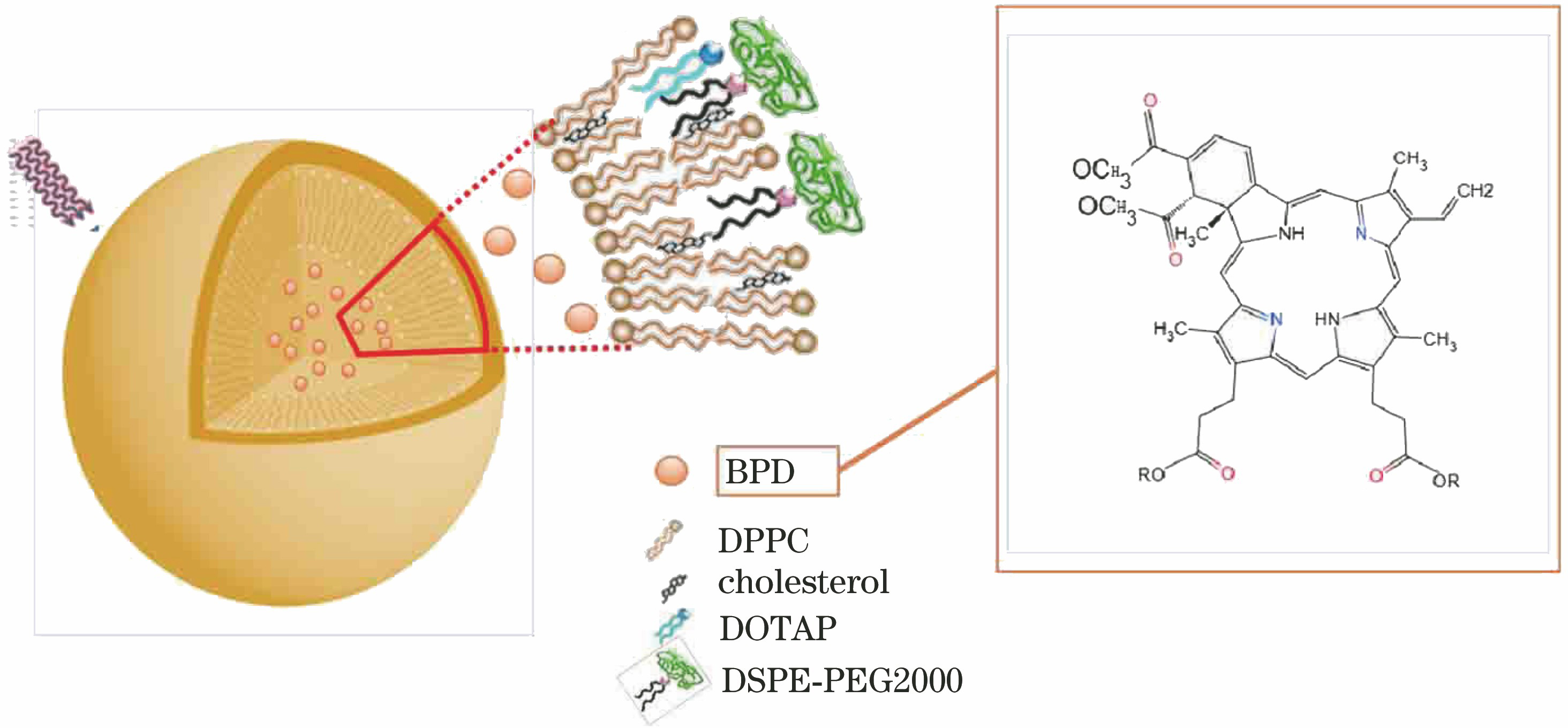
称取1 mg BPD粉末溶于1 mL DMSO溶剂中配制成1 mg/mL的BPD溶液,将其放于4 ℃冰箱中保存。每次实验前将其常温融化后吸取适量配制成所需浓度的溶液。对于脂质体的制备:先将脂质体合成试剂1,2-二棕榈酰-sn-甘油-3-磷酰胆碱(DPPC)、1,2-二油酰基-三甲胺丙烷甲基氯盐(DOTAP)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000铵盐(DSPE-PEG2000)和胆固醇(cholesterol)在氯仿中按10∶1∶1∶5的物质的量比在玻璃试管中混合,再在混合液中加入100 mmol/L溶于丙酮的BPD,并混合均匀;利用氮气作为保护气在避光的条件下用旋转蒸发仪将溶液中的氯仿和丙酮等有机溶剂去除,使混合的物质在试管壁上形成脂质薄膜;将试管壁上的脂质层振荡溶解于溶液中,并进行10次45 ℃水浴和0 ℃冰浴各10 min的交替循环,通过在不同温度相变下打开和闭合脂质体层,使BPD包装在脂质体中;利用美国Avanti Polar Lipids公司的脂质体挤压装置将脂质体溶液透过孔径为0.1 μm的聚碳酸脂膜过滤10次以上,使其成为粒径均一的含BPD的脂质体;再利用300 KD透析系统在4 ℃下将未包装在脂质体中的游离BPD以1∶1000的体积比放入磷酸盐缓冲液中进行过夜透析,去除未包载在脂质体中的游离BPD。制成的脂质体如
2.3 BPD吸收曲线及荧光发射曲线的测量
研究中,分别使用GBC Cintra 2020紫外-可见分光光度计和HORIBA 320荧光光谱仪来测量BPD的紫外吸收曲线及荧光发射曲线。配制的BPD质量浓度分别为0.35,0.70,1.40,2.10,2.80 μg/mL。
2.4 成像参数
本实验采用自行搭建的多模态光学成像系统对Aβ聚集体进行非线性光学成像,系统包括明场成像通道、共聚焦成像通道、双光子荧光成像通道以及二次谐波成像通道。明场成像采用汞灯进行照明,共聚焦成像的激发波长为488 nm,收集通道中心波长为470 nm,二次谐波成像及双光子荧光成像的光源采用飞秒激光器,激发波长为900 nm,收集通道中心波长分别为450 nm和550 nm。使用60×油镜进行成像。
2.5 光照实验
将形成斑块聚集的Aβ溶液滴于共焦皿里,随后加入不同浓度的BPD溶液充分混匀。先对光照前的斑块进行成像,随后将690 nm耦合二极管激光器(MRL-III-690,长春新产业光电子技术有限公司提供)通过光纤固定于载物台上,保持样品不动,以50 mW/cm2激光功率密度进行照射。
2.6 ELISA定量检测
配制质量浓度为60 ng/mL的Aβ溶液,并分为实验组和对照组,其中实验组加入浓度为1 μmol/L 的BPD溶液并以50 mW/cm2的激光功率密度分别照射0,0.5,1,1.5 h,对照组不加入BPD溶液并以相同功率密度的激光照射1.5 h,随后采用Aβ ELISA试剂盒(购于江莱生物)进行检测,通过测量其在450 nm处的吸光度来评估溶液中Aβ的含量。
3 实验结果与讨论
3.1 Aβ斑块的形成
许多蛋白质在合适的环境下会发生轻度变性,并经错误折叠重组形成淀粉样纤维聚集的结构,如升高相应的温度就能使得胰岛素和β-乳球蛋白聚集形成球晶[13]。不同蛋白形成的聚集结构形状各异,受蛋白种类及聚集环境的影响,这些聚集结构的纤维轴骨架大部分由β键构成,并且在结构及化学性质方面具有较好的稳定性[14]。对于Aβ,其在模拟的体外生理环境下(pH=7,37 ℃)也能自发形成聚集体。目前普遍认为Aβ的聚集过程为一种成核的聚集过程,但其具体过程十分复杂,人们希望用一些聚集机理如“dock-lock机理”[15]、“stop and go机理”[16]等对该过程进行解释归纳。已有文章报道Aβ的聚集与其质量浓度密切相关[17],根据预实验选取了质量浓度为0.5 mg/mL的Aβ溶液,将配制的Aβ溶液置于37 ℃的孵育箱中进行孵育并对其进行观察。实验观察到,Aβ斑块的形成具有明显的时间过程,在溶液孵育3 d时,便能观察到Aβ已经从单体逐渐生长成聚集核心,有的核心已经聚集生长出细小的纤维状,如

图 2. Aβ溶液的不同聚集状态。(a) Aβ纤维;(b) Aβ球晶;(c) Aβ斑块
Fig. 2. Different aggregation states of Aβ solution. (a) Aβ fibers; (b) Aβ spherulites; (c) Aβ plaques
3.2 BPD吸收和荧光曲线
对于光敏剂而言,吸光度是其最重要的光学特征。为了确定本研究使用的光敏剂BPD的光学性质,用分光光度计测量了其不同质量浓度下对应的吸收光谱和荧光发射光谱,如

图 3. 不同质量浓度下BPD溶液的紫外吸收及荧光发射谱。(a) BPD紫外吸收谱;(b) BPD吸光度随质量浓度变化的标准曲线;(c) BPD荧光发射谱;(d) BPD荧光发射强度随质量浓度变化的标准曲线
Fig. 3. Absorption and fluorescence emission spectra of BPD solution with different mass concentrations. (a) BPD ultraviolet absorption spectra; (b) standard curve of BPD absorbance varying with mass concentration; (c) BPD fluorescence emission spectra; (d) standard curve of BPD fluorescence intensity varying with mass concentration
3.3 不同浓度BPD对斑块的降解作用
研究中将终值浓度为1,10,100 μmol/L的BPD加入已形成斑块聚集的Aβ溶液中,并设置未加BPD的Aβ溶液作为对照组,研究不同浓度BPD对Aβ斑块的降解作用。实验原理如

图 4. BPD及其脂质体对Aβ聚集体的降解机理
Fig. 4. Degradation mechanism of Aβ aggregates by BPD and its liposomes
实验结果显示,在没有加BPD的对照组中,经过1.5 h的光照,斑块没有出现减小或消失的趋势,这也排除了Aβ斑块自发荧光漂白的可能性,如

图 5. Aβ斑块在仅光照情况下的降解结果。 (a)(e)明场图;(b)(f)共聚焦成像图;(c)(g)二次谐波成像图;(d)(h)双光子荧光成像图
Fig. 5. Degradation results of Aβ plaques with only irradiation. (a)(e) Bright field images; (b)(f) confocal images; (c)(g) second harmonic generation images; (d)(h) two photon excited fluorescence images

图 6. BPD浓度为1 μmol/L情况下光照Aβ斑块的降解结果。(a)(e)明场图;(b)(f)共聚焦成像图;(c)(g)二次谐波成像图;(d)(h)双光子荧光成像图
Fig. 6. Degradation results of Aβ plaques after irradiation when the concentration of BPD is 1 μmol/L. (a)(e) Bright field images; (b)(f) confocal images; (c)(g) second harmonic generation images; (d)(h) two photon excited fluorescence images
当BPD的浓度提高到10 μmol/L时,光照0.5 h斑块已被明显降解,当光照时间持续到1.5 h时,区域内几乎观察不到荧光,证明大部分斑块已被降解,如

图 7. BPD浓度为10 μmol/L情况下光照Aβ斑块的降解结果。(a)(e)(i)(m)明场图;(b)(f)(j)(n)共聚焦成像图;(c)(g)(k)(o)二次谐波成像图;(d)(h)(l)(p)双光子荧光成像图
Fig. 7. Degradation results of Aβ plaques after irradiation when the concentration of BPD is 10 μmol/L. (a)(e)(i)(m) Bright field images; (b)(f)(j)(n) confocal images; (c)(g)(k)(o) second harmonic generation images; (d)(h)(l)(p) two photon excited fluorescence images

图 8. Aβ斑块荧光强度随光照时间的变化图
Fig. 8. Relationship between fluorescence intensity of Aβ plaques and irradiation time

图 9. BPD浓度为100 μmol/L情况下光照Aβ斑块的降解结果。(a)(e)明场图;(b)(f)共聚焦成像图;(c)(g)二次谐波成像图;(d)(h)双光子荧光成像图
Fig. 9. Degradation results of Aβ plaques after irradiation when the concentration of BPD is 100 μmol/L. (a)(e) Bright field images; (b)(f) confocal images; (c)(g) second harmonic generation images; (d)(h) two photon excited fluorescence images

图 10. BPD对Aβ斑块的降解效率随浓度的变化关系
Fig. 10. Relationship between degradation efficiency of Aβplaques and concentration of BPD
3.4 ELISA检测
在使用ELISA试剂盒检测光照前后的Aβ含量的实验中发现,在未加BPD的Aβ溶液中,即便以50 mW/cm2的激光功率密度照射1.5 h后,实验结果的吸光度与光照0 h的相差无几,证明Aβ的含量几乎没有发生变化。随后加入BPD进行光照,在相同的激光功率密度下,光照0.5 h后其吸光度明显降低,证明溶液中Aβ含量已经明显减少,如

图 11. 不同剂量光照后Aβ含量变化的ELISA检测结果
Fig. 11. ELISA detection results of Aβ content after irradiation with different doses
3.5 脂质体对斑块的降解作用
相比于BPD分子,脂质体的BPD在临床应用上具有更广阔的前景,应用纳米技术可以对脂质体进行各种修饰,使之适应于不同的治疗环境[21]。在本实验中,由于BPD属于疏水性药物分子,在水中溶解性差且易发生聚集,因此需要在DMSO溶解后,再用水稀释。而DMSO具有一定毒性,不利于临床应用。而脂质体可在水溶性环境中稳定存在,并已在临床上广泛应用,所以将BPD分子包载到脂质体的磷脂双分子层中,可有效防止BPD聚集,提高药物的运输效率和生物相容性。当脂质体与Aβ溶液共同孵育时,BPD分子可在光照时通过光动力作用破坏脂质层,并释放到溶液中与Aβ斑块相互作用。同时对BPD分子进行包封还可以保护它不受光漂白的影响,从而延长单线态氧的寿命,提高对Aβ斑块的降解效率。如

图 12. 加入BPD脂质体情况下光照Aβ斑块的降解结果。 (a)(e)明场图;(b)(f)共聚焦成像图;(c)(g)二次谐波成像图;(d)(h)双光子荧光成像图
Fig. 12. Degradation results of Aβ plaques after irradiation with BPD liposome. (a)(e) Bright field images; (b)(f) confocal images; (c)(g) second harmonic generation images; (d)(h) two photon excited fluorescence images
4 结论
基于Aβ斑块具有自体荧光的性质,采用双光子荧光和二次谐波成像对其进行无标记成像观察,实时观察斑块的变化,并利用光动力作用实现对Aβ斑块的降解。之前的研究已验证光照激发后BPD能够对肿瘤细胞起到一定的杀伤作用,并能通过光声进行成像。此次研究对之前的研究进行扩展,通过制备不同浓度的BPD溶液,研究BPD在斑块降解中的量效关系,实验得到BPD浓度在10 μmol/L的情况下能够成功地降解Aβ斑块,并通过ELISA实验得到了证实。除此之外,还制备了包裹BPD的脂质体,并验证了其对Aβ斑块同样具有降解作用。双光子荧光和二次谐波成像有利于活体检测,能够对Aβ斑块实现无标记成像,而光动力治疗只有在特定的激发波长条件下才能产生作用,能够以较小的损伤实现对Aβ斑块的降解,两者结合能够为阿尔兹海默症的检测和治疗提供一种重要的研究手段。
[1] Prince M. Progress on dementia: leaving no one behind[J]. The Lancet, 2017, 390(10113): e51-e53.
[2] Adlard P A, Tran B A, Finkelstein D I, et al. A review of β-amyloid neuroimaging in Alzheimer's disease[J]. Frontiers in Neuroscience, 2014, 8: 327.
[3] Schnabel J. Amyloid: little proteins, big clues[J]. Nature, 2011, 475(7355): S12-S14.
[4] Dong J H, Revilla-Sanchez R, Moss S, et al. Multiphoton in vivo imaging of amyloid in animal models of Alzheimer's disease[J]. Neuropharmacology, 2010, 59(4/5): 268-275.
[5] Ji MB, ArbelM, Zhang LL, et al., 2018, 4(11): eaat7715.
[6] Celli J P, Spring B Q, Rizvi I, et al. Imaging and photodynamic therapy: mechanisms, monitoring, and optimization[J]. Chemical Reviews, 2010, 110(5): 2795-2838.
[8] 蓝善优, 张达, 刘小龙, 等. 肿瘤微环境响应的智能纳米载体在肿瘤光动力治疗中的应用[J]. 中国激光, 2018, 45(2): 0207008.
[9] 张君颖. 基于纳米材料的β-淀粉样蛋白聚集体的分析检测和抑制研究[D]. 上海: 华东师范大学, 2016.
Zhang JY. Study on detection and aggregation inhibition of amyloid β based on nanomaterials[D]. Shanghai: East China Normal University, 2016.
[10] Ahn M, Lee B I, Chia S, et al. Chemical and mechanistic analysis of photodynamic inhibition of Alzheimer's β-amyloid aggregation[J]. Chemical Communications, 2019, 55(8): 1152-1155.
[11] Lee B I, Suh Y S, Chung Y J, et al. Shedding light on Alzheimer's β-amyloidosis: photosensitized methylene blue inhibits self-assembly of β-amyloid peptides and disintegrates their aggregates[J]. Scientific Reports, 2017, 7: 7523.
[12] 赵一铭, 刘成程, 王晶, 等. 基于稀土上转换发光纳米平台的光动力抗菌疗法的研究进展[J]. 中国激光, 2018, 45(2): 0207013.
[13] Johansson P K, Koelsch P. Label-free imaging of amyloids using their intrinsic linear and nonlinear optical properties[J]. Biomedical Optics Express, 2017, 8(2): 743-756.
[14] Whittingham J L, Scott D J, Chance K, et al. Insulin at pH 2: structural analysis of the conditions promoting insulin fibre formation[J]. Journal of Molecular Biology, 2002, 318(2): 479-490.
[15] Esler W P, Stimson E R, Jennings J M, et al. Alzheimer's disease amyloid propagation by a template-dependent dock-lock mechanism[J]. Biochemistry, 2000, 39(21): 6288-6295.
[17] Exley C, House E, Collingwood J, et al. Spherulites of Aβ42in vitro and in Alzheimer's disease[J]. Nature Precedings, 2009.
[19] del Mercato L L, Pompa P P, Maruccio G, et al. Charge transport and intrinsic fluorescence in amyloid-like fibrils[J]. Proceedings of the National Academy of Sciences, 2007, 104(46): 18019-18024.
[21] Zhang J, Liu J, Zhu Y, et al. Photodynamic micelles for amyloid β degradation and aggregation inhibition[J]. Chemical Communications, 2016, 52(81): 12044-12047.
Article Outline
黄燕霞, 许皓, 栾萍, OhulchanskyyTymishY, 屈军乐. β-淀粉样蛋白斑块的无标记成像及光动力降解[J]. 中国激光, 2020, 47(2): 0207029. Huang Yanxia, Xu Hao, Luan Ping, Ohulchanskyy Tymish Y, Qu Junle. Label-Free Imaging of β-Amyloid Plaques and Photodynamic Degradation[J]. Chinese Journal of Lasers, 2020, 47(2): 0207029.